浙教版科学八年级下册复习专题10:探究专练(2)
试卷更新日期:2021-04-11 类型:复习试卷
一、实验探究题
-
1. 日常生活中使用的塑料袋有用聚乙烯制成的,也有用聚氯乙烯制成的。小明同学听说包装食品的塑料袋应该是前者而不是后者,便设计了一个实验方案,用平常在超市买东西时带回来的塑料袋进行探究,以验证其成分。
查阅资料:聚乙烯(由C、H两种元素组成)燃烧生成CO2和H2O;
聚氯乙烯(由C、H、Cl三种元素组成)燃烧生成CO2、H2O和HCl。
实验探究:为了确定塑料袋的燃烧产物,请将实验装置的接口abcdef按气体流经的次序连接起来。连接次序为a→→f。然后进行探究。
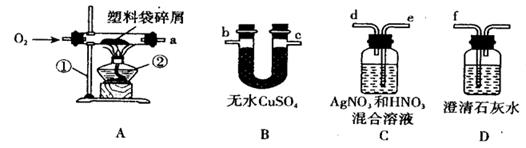
小明取12.5g塑料袋碎片放在硬质玻璃管中,鼓人充足的氧气使之燃烧,在实验过程中若B、C、D装置都产生明显的现象,并将B、C装置质量的变化记录在下表中。
实验前
实验后
B装置的质量/g
213.6
217.2
C装置的质量/g
200.2
207.5
则该塑料袋是用制成的。(填“聚氯乙烯”或“聚乙烯”)该塑料袋中C、H元素的质量比为。
【实验反思】连接实验装置时,能否将装置C、D顺序调换?请简述理由。
答:.
-
2. 某实验学校初三兴趣小组利用如下装置(部分固定装置已略去)。制备氮化钙,(氯化钙是一种棕色粉末,常温下与空气中的氧气和水都发生反应)。并探究其化学式。
 (1)、反应过程中末端导管必须插入试管A的水中,目的是 。(2)、制备氮化钙的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;③反应结束后, (填写应进行的操作);④拆除装置,取出产物。(3)、数据记录如下:
(1)、反应过程中末端导管必须插入试管A的水中,目的是 。(2)、制备氮化钙的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;③反应结束后, (填写应进行的操作);④拆除装置,取出产物。(3)、数据记录如下:空硬玻璃管质量m0/g
硬玻璃管与钙的质量m1/g
硬玻璃管与产物的质量m2/g
114.8
120.8
122.2
①计算得到化学式(实验式)CaxN2 , 其中x=。
②若通入的N2中混有少量O2 , 如上计算得到的x的值(填写“偏大”、“偏小”、“不变”)。
-
3. 用含有二氧化碳和水蒸气杂质的某种还原性气体测定一种铁的氧化物(FexOy)的组成,实验装置如图所示。根据下图,试回答:
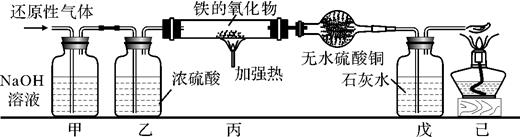 (1)、实验过程中丁装置白色粉末变蓝色,而戊装置中溶液没有明显变化,则该还原性气体是.(2)、当丙装置中的FexOy,全部被还原后,称量剩余固体的质量为11.2克,同时测得丁装置的质量增加了5.4克。则该铁的氧化物的化学式为。(3)、上述实验装置中,如果没有乙装置,将使测定结果中铁元素与氧元素的质量的比值。(填“偏大”、“偏小”或“无影响”)
(1)、实验过程中丁装置白色粉末变蓝色,而戊装置中溶液没有明显变化,则该还原性气体是.(2)、当丙装置中的FexOy,全部被还原后,称量剩余固体的质量为11.2克,同时测得丁装置的质量增加了5.4克。则该铁的氧化物的化学式为。(3)、上述实验装置中,如果没有乙装置,将使测定结果中铁元素与氧元素的质量的比值。(填“偏大”、“偏小”或“无影响”) -
4. 人们为了揭示原子结构的奥秘,经历了漫长的探究过程。以下是英国科学家卢瑟福进行的探究。
【过程与现象】1911年英国科学家卢瑟福进行了著名的α粒子(带正电)轰击金箔实验。结果发现:绝大多数α粒子穿过金箔后仍沿原方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的几乎达到180°,像是被金箔弹了回来。
【解释与结论】
(1)、绝大多数α粒子穿过金箔后方向不变,说明;(2)、通过上述实验,可推出的原子结构模型为;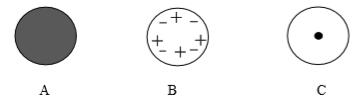 (3)、【分析与应用】当α粒子轰击金箔时,如图所示的运动轨迹不可能是(填字母)。
(3)、【分析与应用】当α粒子轰击金箔时,如图所示的运动轨迹不可能是(填字母)。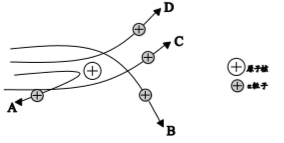
-
5. 在α粒子散射实验中,绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,甚至有极少数α粒子几乎达到180°,像是被金箔弹了回来。α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料。卢瑟福推测:除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
 (1)、支持卢瑟福推测的依据是。(2)、1um金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明 。A、原子的质量是均匀分布的 B、原子内部绝大部分空间是空的(3)、1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒是。
(1)、支持卢瑟福推测的依据是。(2)、1um金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明 。A、原子的质量是均匀分布的 B、原子内部绝大部分空间是空的(3)、1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒是。 -
6. 小林同学收集了一些微粒的资料,请你和他一起根据表格数据回答下列问题。
微粒名称
质子数
中子数
电子数
带电性
A
14
14
14
不带电
B
26
30
24
带2个单位正电荷
C
14
14
16
D
14
16
14
不带电
(1)、表格中属于互为同位素的是。(2)、根据表格信息写出微粒C的符号。(3)、比较C与D两种微粒,其中质量较大的是。 -
7. 如图是 1~18 号元素原子最外层电子数与原子核电荷数的关系图。试回答:
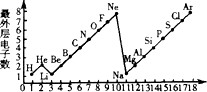 (1)、一个 Mg2+核外共有个电子;Cl-的最外层电子数和原子的最外层电子数相同;(2)、通过对该图的分析,你能发现哪些规律?请写出其中一个。
(1)、一个 Mg2+核外共有个电子;Cl-的最外层电子数和原子的最外层电子数相同;(2)、通过对该图的分析,你能发现哪些规律?请写出其中一个。 -
8. 俗话说“骨头的精髓在汤里”。有人认为骨头中钙、磷含量雄厚,骨头汤必然钙含量很高,是补钙的好材料。为了验证骨头汤能否有效补钙,某科研小组将猪排骨 500g、蒸馏水 1500mL、食用醋 70mL,加热煮沸后维持 70 分钟,得到骨头汤 1243mL,用仪器检测结果:每 100mL 骨头汤含有 2mg 钙(而每 100mL 牛奶约含有 105mg 钙)。
查阅资料:人体骨骼中的钙存在形式是羟基磷酸钙[Ca10(PO4)6(OH)2],该物质难溶于水。人体平均每天需要补钙 800mg。
(1)、“骨头汤能补钙”中的钙是指 (填字母编号);A、钙离子 B、单质钙 C、钙元素 D、羟基磷酸钙(2)、羟基磷酸钙中磷元素的化合价是价 ;(3)、假设某人只能从骨头汤中获取钙,则此人每天需要喝L 骨 头 汤 ;(4)、某品牌钙片每片的规格是:维生素 D3100IU(相当于 2.5 微克),碳酸钙 1000mg,若某人只从钙片中获取钙,则每天需要服用此品牌钙片片。 -
9. 食醋是厨房中常用的调味品、它的主要成分是乙酸,乙酸分子的模型如图所示,其中“
 ”代表一个碳原子,“
”代表一个碳原子,“  ”代表一个氢原子,“
”代表一个氢原子,“  ”代表一个氧原子,请计算:
”代表一个氧原子,请计算: 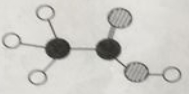 (1)、乙酸分子中的碳原子、氢原子、氧原子的个数比为。
(1)、乙酸分子中的碳原子、氢原子、氧原子的个数比为。
(2)、乙酸中碳元素的质量分数为。 -
10. 科学理论的建立要有一个又一个的证据。在研究原子结构的历史进程中,卢瑟福揭开了原子世界一个又一个的奥秘。请回答:(1)、1911年,卢瑟福等人进行了α粒子(α粒子是带两个单位正电荷的氦原子核)散射实验,用一些高速运动的α粒子轰击金箔,发现多数α粒子穿过金箔后仍保持原来的运动方向,但有少数α粒子发生了较大角度的偏转,而极少数α粒子发生反弹。下列说法正确的有 。A、多数α粒子保持原来的运动方向,说明原子核的体积很小 B、少数α粒子发生较大角度偏转,说明原子核带负电 C、极少数α粒子发生反弹,说明原子核的质量很大(2)、1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒一定是。
-
11. 微观粒子看不见、摸不着,化学中通过模型来说明他们心目中粒子的“模样”,揭示物质的微观结构特点,解释微观结构与宏观现象之间的因果关系。对原子结构的研究,一百多年来科学家借助构建原子结构模型,逐渐揭开了原子构成的神秘面纱,并通过不断提出新的原子结构模型,逐步形成了今天的原子结构理论。
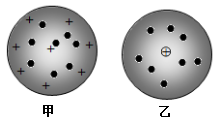 (1)、如图两种模型是汤姆森和卢瑟福分别于1897年和1911年提出的,其中(选填“甲”或“乙”)是由汤姆森提出的。(2)、下列关于原子结构理论的学说中,汤姆森的观点是;(选填字母),卢瑟福的观点是;
(1)、如图两种模型是汤姆森和卢瑟福分别于1897年和1911年提出的,其中(选填“甲”或“乙”)是由汤姆森提出的。(2)、下列关于原子结构理论的学说中,汤姆森的观点是;(选填字母),卢瑟福的观点是;A.原子是不可分的 B.原子是可分的
C.原子呈球形 D.电子带负电
E.带正电荷的原子核居于原子的中心
F.在球体内充斥着正电荷,电子镶嵌其中
G.带正电荷的原子核很小,但集中了原子的大部分质量
H.电子在原子核外很大的空间内高速运动
-
12. 探究原子结构的奥秘。
【实验过程】1910 年英国科学家卢瑟福进行了著名的α 粒子(带正电)轰击金箔实验。结果发现: 绝大多数α 粒子穿过金箔后仍沿原方向前进,但是有少数 α 粒子却发生了较大的偏转,并且有极少数α 粒子的偏转超过 90°,有的甚至几乎达到 180°,像是被金箔弹了回来。
【解释与结论】
(1)、卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是 。(2)、1um 金箔包含了 3000 层金原子,绝大多数α 粒子穿过后方向不变,说明 ;A、原子的质量是均匀分布的 B、原子内部绝大部分空间是空的(3)、科学家对原子结构的探究经历了三个过程,通过 α 粒子散射实验,你认为原子结构为以下的。

-
13.
如图是在高温高压、催化剂条件,氮气和氢气发生反应生成氨气的微观模拟图,其中
 分别表示氮原子和氢原子。
分别表示氮原子和氢原子。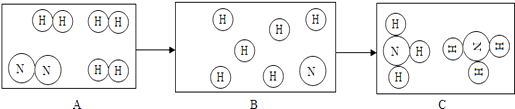
请回答下列问题:
(1)、在B中补充画出相关粒子图形,使其表示正确;(2)、补充的依据是(3)、结合该图示从微观角度解释由B到C变化的实质是。 -
14. 碘是一种由碘分子构成的非金属,某同学利用碘进行了如下的实验:(1)把少量的固体碘放在湿润的馒头上,发现馒头会变蓝色;(2)再取少量的碘溶解在水中,用馒头去沾取碘液,发现馒头也会变蓝色。则:(1)、取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头变蓝色(填“会”或“不会”)。(2)、把碘溶解在酒精中,可以得到消毒用的碘酒,用馒头去沾取少量的碘酒,馒头 (填“会”或“不会”)变蓝色。
(3)、请用分子的观点来解释实验中的现象。 -
15. 化合价是一个重要的化学概念.(1)、下面是对元素化合价的部分探究过程.
化学上用“化合价”来表示原子之间 .
(2)、【提出问题一】元素正负化合价有何规律?推测一:金属元素都显正价;
推测二:非金属元素只有负价.
【举例及分析一】
①.NaCl、FeO、Al2O3中金属元素化合价分别为+1、+2、+3,其他金属也都显正价,推测一正确.金属都显正价的可能原因为 .
②.H2O、SO2、CO2中H、O、S、C元素的化合价分别为+1、﹣2、+4、+4,说明推测二(填“成立”或“不成立”).
③金属元素与非金属元素形成化合物时,非金属元素显价.
(3)、【提出问题二】一种元素只有一种化合价吗?推测一:一种元素只有一种化合价;
推测二: .
【举例及分析二】
①NaCl、NaOH、NaNO3、Na2SO4等物质中Na元素都显+1价,推测一成立.
②H2S、SO2、SO3、H2SO3等物质中S元素化合不同,S元素化合价分别为﹣2、+4、+6、价.推测二成立.
【结论二】推测一、二都有道理,通过上述举例分析及结合教材上所给元素的化合价,可知
(4)、【提出问题三】在同种化合物中,同种元素一定具有相同的化合价吗?推测一:在同种化合物中,同种元素一定具有相同的化合价;
推测二:在同种化合物中,同种元素不一定具有相同的化合价.
【举例及分析三】NH4NO3中N元素的化合价分别为、 .
【结论三】推测二成立.
-
16. 为了降低城乡居民因食物和饮用水中含碘量不足而导致碘缺乏症的发病率,我国已执行食盐加碘的法规,制定了“碘盐”的国家标准.市售二级碘盐的商品包装上标明“主要配料:食盐、碘酸钾;氯化钠含量:94%;含碘量:25.4mg/kg”.(1)、市售的每千克二级碘盐中,含碘酸钾(KIO3)mg;(相对原子质量I 127;O 16;K 39)(2)、制造碘盐并不直接使用碘(单质)而是使用碘酸钾,主要原因可能有 ;A、碘酸钾的价格较低,有利于减轻居民食用碘盐的经济负担 B、碘酸钾较易溶解于水,有利于碘盐生产操作和食用吸收 C、碘酸钾热稳定性优于碘,有利于碘盐生产、贮放、使用过程中减少碘的损失(3)、为检验某食用盐试样中是否含有碘元素,某同学确定采用以下反应进行实验:KIO3+5KI+3H2SO4(稀)=3I2+3K2SO4+3H2O.这一反应中碘元素化合价最高是价;要达到实验目的,就需要产生到明显的现象,所以除了KI、稀硫酸外,他还应选用的一种试剂是 .
