浙教版科学八年级下册复习专题04:元素符号
试卷更新日期:2021-04-09 类型:复习试卷
一、单选题
-
1. 决定元素种类的是( )A、电子数 B、中子数 C、最外层电子数 D、质子数2. 下列关于原子核构成的说法正确的是( )A、一般由质子和电子构成 B、一般由质子和中子构成 C、一般由电子和中子构成 D、一般由质子、中子和电子构成3. 我国著名科学家张青莲教授主持测定了铕等9种原子质量新值,已知铕原子的相对原子质量为152,核电荷数为63,则铕原子的核外电子为( )A、63 B、89 C、152 D、2154. 下列关于元素的理解,正确的是( )A、元素的种类取决于该元素原子的核外电子数 B、中子数相等的原子的统称叫元素 C、元素既论种数,也可计个数 D、自然界中所有的物质都是由元素组成的5. 下列排序正确的是( )A、地壳中元素的含量: B、硫元素的化合价: C、空气中物质的质量: D、原子序数排列:6. 某反应的微观示意图如下(一种小球代表一种元素的原子),下列说法错误的是 ( )
 A、该反应中共有三种元素 B、甲是化合物,乙是单质 C、乙和丁中同种元素的化合价相等 D、反应中原子的种类没有发生改变7. 生活中常会见到“加碘盐”、“含氟牙膏”、“加铁酱油”,其中的“碘”、“氟”、“铁”指的是( )A、原子 B、离子 C、元素 D、分子8. 如图是元素周期表中的一格,从该图中获取的相关信息中错误的是( )
A、该反应中共有三种元素 B、甲是化合物,乙是单质 C、乙和丁中同种元素的化合价相等 D、反应中原子的种类没有发生改变7. 生活中常会见到“加碘盐”、“含氟牙膏”、“加铁酱油”,其中的“碘”、“氟”、“铁”指的是( )A、原子 B、离子 C、元素 D、分子8. 如图是元素周期表中的一格,从该图中获取的相关信息中错误的是( ) A、该元素的名称是镁 B、该元素的原子核外电子数是12 C、该元素的原子序数是12 D、该元素的一个原子的实际质量是24.31g9. 下列元素分类正确的是( )A、金属元素:钙、镁、钡、铜、铁、汞 B、非金属元素:碳、氢、氧、氮、磷、金 C、稀有气体元素:氦、氖、氩、氪、氯、氡 D、人体必需的微量元素:铁、碘、氟、硒、钙、铅10. 著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动地放射出一些特定的粒子。一种元素的原子经过放射变成了另一种元素的原子,据此推断放射出的粒子一定是( )A、电子 B、中子 C、质子 D、原子核11. 如图为元素周期表的一部分,A~E代表五种不同元素。下列说法不正确的是( )
A、该元素的名称是镁 B、该元素的原子核外电子数是12 C、该元素的原子序数是12 D、该元素的一个原子的实际质量是24.31g9. 下列元素分类正确的是( )A、金属元素:钙、镁、钡、铜、铁、汞 B、非金属元素:碳、氢、氧、氮、磷、金 C、稀有气体元素:氦、氖、氩、氪、氯、氡 D、人体必需的微量元素:铁、碘、氟、硒、钙、铅10. 著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动地放射出一些特定的粒子。一种元素的原子经过放射变成了另一种元素的原子,据此推断放射出的粒子一定是( )A、电子 B、中子 C、质子 D、原子核11. 如图为元素周期表的一部分,A~E代表五种不同元素。下列说法不正确的是( ) A、原子序数:C>B B、核内质子数:A=E C、B,C同周期 D、A,D同族12. 法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。它与天体中的中子星构成类似。有关该粒子的说法不正确的是( )A、不显电性 B、相当于一个氦(He)原子的质量 C、失去一个中子后也不显电性 D、在周期表中与氢元素占同一位置13. 具有相同质子数和不同中子数的同一元素的不同原子互称同位素。氘和氚是核聚变的原料,已知氘、氚原子核内都只有1个质子,但含不同数目的中子,聚变发生后,氘、氚原子核转变为氦原子核。根据以上叙述,下列说法正确的是( )A、氘和氘与氢的原子序数不同 B、氘原子和氚原子是氢的不同元素 C、氘原子和氚原子是氢的两种同位素 D、氘原子和氚原子的相对原子质量相同14. 原子和分子的根本区别是( )A、大小不同 B、在化学反应中能否再分 C、能否保持物质的物理性质 D、能否直接构成物质15. 十九世纪初,意大利科学家阿伏加德罗在总结前人工作的基础上,提出的分子概念认为:①一切物质都是由分子组成的;②分子由原子构成;③原子不能独立存在;④分子是保持物质化学性质的一种粒子;⑤分子的质量等于构成它的原子的质量之和;⑥分子在不停的运动。通过你的学习,你认为上述观点中存在明显不足的是( )A、①②⑤ B、①③ C、④⑤⑥ D、③⑤16. 知识梳理有助于我们对已学知识进行巩固,如图所示,某同学学习物质结构层次后以氧气为例进行了梳理,下列选项中与a、b、c相对应的是( )
A、原子序数:C>B B、核内质子数:A=E C、B,C同周期 D、A,D同族12. 法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。它与天体中的中子星构成类似。有关该粒子的说法不正确的是( )A、不显电性 B、相当于一个氦(He)原子的质量 C、失去一个中子后也不显电性 D、在周期表中与氢元素占同一位置13. 具有相同质子数和不同中子数的同一元素的不同原子互称同位素。氘和氚是核聚变的原料,已知氘、氚原子核内都只有1个质子,但含不同数目的中子,聚变发生后,氘、氚原子核转变为氦原子核。根据以上叙述,下列说法正确的是( )A、氘和氘与氢的原子序数不同 B、氘原子和氚原子是氢的不同元素 C、氘原子和氚原子是氢的两种同位素 D、氘原子和氚原子的相对原子质量相同14. 原子和分子的根本区别是( )A、大小不同 B、在化学反应中能否再分 C、能否保持物质的物理性质 D、能否直接构成物质15. 十九世纪初,意大利科学家阿伏加德罗在总结前人工作的基础上,提出的分子概念认为:①一切物质都是由分子组成的;②分子由原子构成;③原子不能独立存在;④分子是保持物质化学性质的一种粒子;⑤分子的质量等于构成它的原子的质量之和;⑥分子在不停的运动。通过你的学习,你认为上述观点中存在明显不足的是( )A、①②⑤ B、①③ C、④⑤⑥ D、③⑤16. 知识梳理有助于我们对已学知识进行巩固,如图所示,某同学学习物质结构层次后以氧气为例进行了梳理,下列选项中与a、b、c相对应的是( ) A、原子、原子核、核外电子 B、原子核、原子、核外电子 C、原子、核外电子、原子核 D、核外电子、原子核、原子
A、原子、原子核、核外电子 B、原子核、原子、核外电子 C、原子、核外电子、原子核 D、核外电子、原子核、原子二、填空题
-
17. 根据所给的元素名称填写元素符号
①镁 ②铝 ③锂 ④氧 ⑤钙
⑥氩 ⑦氟 ⑧碳 ⑨氯 ⑩磷
18. 我市一些街道边新安装了“太阳能垃圾箱”。该垃圾箱“头顶”光电池板,“腰挎”广告灯箱,“脚踩”垃圾桶。(1)、太阳能电池板的主要材料为硅,硅属于(选填“金属”或“非金属”)(2)、废电池应该投入到其中的垃圾桶 (选填“可回收”或“不可回收”),以防渗漏出的汞、镉、铅等重金属离子对土壤和水源造成污染。19. 成语中被填的字与元素名称谐音,根据下面的示范,用相应元素符号填写成语。高山(S)水,功高(Ca)世,
十全十 , 拾不昧,
雪中送 , 叶落根,
石心肠,火树花。
20. 空气中含量最多的元素为 , 地壳中含量最多的元素为 , 地核中含量最多的元素为 , 太阳中含量最多的元素为 , 海水中含量最多的元素为;人体中含量最多的元素为。(均填元素符号)21. IUPAC元素系统命名法是一种序数命名法,它采用新元素的原子序数(即核电荷数)的拉丁文缩写来命名,即nil-0,un-l,bi-2,tri-3,quad-4,pent-5,hex-6,sept-7,oct-8,enn-9。照此规定,第104号元素的拉丁文名称按“un+nil+quad+ium(词缀)”应为“Unnilquadium”,其元素符号定为“Unq”,第105号元素的拉丁文名称为“Unnilpentium”,元素符号为“Unp”,依此类推。请分别给下列元素命名:(1)、第109号元素的拉丁文名称为 , 元素符号为。(2)、第116号元素的拉丁文名称为 , 元素符号为。22. 根据如图甲、乙、丙三幅元素含量示意图,试推测元素分布领域(填图下序号):分布在人体中的是;分布在海水中的是;分布在地壳中的是。 23. 在原子中,核电荷数==。原子核和核外电子所带的电量大小相等,电性相反,因而原子呈电。24. 人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。卢瑟福核式结构模型是在α粒子轰击金箔实验的基础上提出的。把一束高速运动的α粒子(带2个单位正电荷),射向一片极薄的金箔。他惊奇地发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列成的金箔,竟为大多数α粒子畅通无阻地通过,就像金箔不在那儿似的,但也有极少数的α粒子发生偏转,或笔直的弹回。根据上述实验现象能得出关于金箔中金原子结构的一些结论,试写出其中的三点:(1)、。(2)、。(3)、。25. 如图所示代表三种原子的原子核,请回答下列问题:
23. 在原子中,核电荷数==。原子核和核外电子所带的电量大小相等,电性相反,因而原子呈电。24. 人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。卢瑟福核式结构模型是在α粒子轰击金箔实验的基础上提出的。把一束高速运动的α粒子(带2个单位正电荷),射向一片极薄的金箔。他惊奇地发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列成的金箔,竟为大多数α粒子畅通无阻地通过,就像金箔不在那儿似的,但也有极少数的α粒子发生偏转,或笔直的弹回。根据上述实验现象能得出关于金箔中金原子结构的一些结论,试写出其中的三点:(1)、。(2)、。(3)、。25. 如图所示代表三种原子的原子核,请回答下列问题:这三种原子的原子核内均含有个质子,所以它们属于同种 , 但中子数不同,它们是氢的。

三、解答题
-
26. H、 H、 H分别表示氢元素的三种原子,其上、下标的意义如图所示。 H、 H、 H可简写成1H、2H、3H。
 (1)、1H、2H、3H三种原子中,数目不等(选填“质子”或“中子”或“电子”);(2)、相同分子数的2H2和3H2分别与足量O2反应全部转化成H2O,生成的质量前者(选填“大于”或“等于"或“小于”)后者。27. 元素周期表是学习和研究化学的重要工具。如图是元素周期表部分内容,请根据表中信息完成相关问题。
(1)、1H、2H、3H三种原子中,数目不等(选填“质子”或“中子”或“电子”);(2)、相同分子数的2H2和3H2分别与足量O2反应全部转化成H2O,生成的质量前者(选填“大于”或“等于"或“小于”)后者。27. 元素周期表是学习和研究化学的重要工具。如图是元素周期表部分内容,请根据表中信息完成相关问题。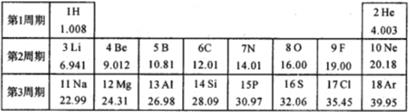 (1)、第三周期中的稀有气体元素的质子数是。(2)、元素周期表的纵行叫做族,分为主族、副族、VⅢ族和0族。主族用字母“A”来表示,共有七个主族,依次用IA族、ⅡA族、ⅢA族、ⅣA族、VA族、ⅥA族、VⅡA族表示。同主族元素化学性质相似。X²+的核外电子数目为18,则X在第四周期第族。(3)、下列各组中的两种元素具有相似化学性质的是 。A、N C B、F Cl C、Mg Al D、Ne Na(4)、核电荷数1-18的非金属元素A和B,可形成原子个数比1:1和2∶1的两种常温下的化合物,写出这两种化合物的化学式。28. 伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是:一切东西都是由原子构成”。人类在探索物质是由什么构成的历史长河中,充满了智慧。(1)、1803年,近代化学之父,英国科学家道尔顿(Dalton J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。
(1)、第三周期中的稀有气体元素的质子数是。(2)、元素周期表的纵行叫做族,分为主族、副族、VⅢ族和0族。主族用字母“A”来表示,共有七个主族,依次用IA族、ⅡA族、ⅢA族、ⅣA族、VA族、ⅥA族、VⅡA族表示。同主族元素化学性质相似。X²+的核外电子数目为18,则X在第四周期第族。(3)、下列各组中的两种元素具有相似化学性质的是 。A、N C B、F Cl C、Mg Al D、Ne Na(4)、核电荷数1-18的非金属元素A和B,可形成原子个数比1:1和2∶1的两种常温下的化合物,写出这两种化合物的化学式。28. 伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是:一切东西都是由原子构成”。人类在探索物质是由什么构成的历史长河中,充满了智慧。(1)、1803年,近代化学之父,英国科学家道尔顿(Dalton J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。
1897年,汤姆森通过实验发现了电子,进一步发展了原子、分子论。汤姆森主要是纠正了“道尔顿原子论”中的观点。
1911年,卢瑟福又通过实验,推测原子是由和核外电子构成,并提出了沿用至今的现代原子结构理论。
(2)、道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆森和卢瑟福这样,对实验现象进行解释的过程叫做。原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了来表达他们的理论成果。
四、实验探究题
-
29. 人类对原子结构的认识永无止境。请根据所学知识回答:(1)、道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今这些观点均 (填“正确”或“错误”)。
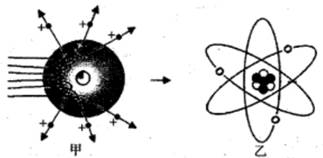 (2)、卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由原子核和核外电子构成。如图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是个 。A、建立模型的过程 B、得出结论的过程 C、提出问题的过程 D、验证证据的过程(3)、卢瑟福在α散射实验中(α粒子带正电荷),断定原子中的绝大部分空间是空的,他的依据是:。30. 19世纪以前,人们一直认为原子是不可分的。1897年汤姆生发现了带负电的电子,并提出类似“西瓜”的原子模型。为进一步探究原子的结构,1911年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。
(2)、卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由原子核和核外电子构成。如图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是个 。A、建立模型的过程 B、得出结论的过程 C、提出问题的过程 D、验证证据的过程(3)、卢瑟福在α散射实验中(α粒子带正电荷),断定原子中的绝大部分空间是空的,他的依据是:。30. 19世纪以前,人们一直认为原子是不可分的。1897年汤姆生发现了带负电的电子,并提出类似“西瓜”的原子模型。为进一步探究原子的结构,1911年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,只有少数α粒子发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)、卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是;(2)、能说明原子内部绝大部分是空的证据是 ;(3)、根据卢瑟福的实验所产生的现象,不能够获得的结论是 ;A、原子核体积很小 B、原子核质量较大 C、原子核带正电 D、核外电子带负电(4)、请你根据对原子结构的认识,分析原子不显电性的原因。31. 碘是一种由碘分子构成的非金属单质,某同学利用碘进行了如下的实验:①把少量的固体碘放在湿润的馒头上,发现馒头会变蓝色(提示:碘分子能使馒头中的淀粉变蓝色);
②再取少量的碘溶解在水中,用馒头去蘸取碘液,发现馒头也会变蓝色。则:
(1)、取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头 (填会或不会)变蓝色。(2)、由上述三个实验可知,分子是。(3)、现在市场上买来的食盐都是加碘盐(含有KIO,),用馒头沾取少量的食盐水(填会或不会)变蓝色。32. 为纪念门捷列夫制作的元素周期表问世150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表是学习化学的重要工具,它反映了元素性质的递变规律和元素之间的内在联系。如图是元素周期表一部分的电子层排布规律,我们对它们进行研究: (1)、第17号元素属于元素(填“金属”或“非金属”),它在化学反应中容易电子(填“得”或“失”);(2)、元素周期表中每一个横行叫做一个周期,每一个纵列叫做一个族,下列说法正确的是 。A、同一周期,各元素原子的电子层数相同 B、同一周期,各元素原子的最外层电子数相同 C、同一族,各元素原子的电子层数相同 D、同一族,各元素原子的最外层电子数相同
(1)、第17号元素属于元素(填“金属”或“非金属”),它在化学反应中容易电子(填“得”或“失”);(2)、元素周期表中每一个横行叫做一个周期,每一个纵列叫做一个族,下列说法正确的是 。A、同一周期,各元素原子的电子层数相同 B、同一周期,各元素原子的最外层电子数相同 C、同一族,各元素原子的电子层数相同 D、同一族,各元素原子的最外层电子数相同