四川省泸州市2021年高考理综-化学一模试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 《天工开物》中记载:“凡铸钱每十斤,红铜(纯铜)居六七,倭铅(锌)居三四,倭铅每见烈火必耗四分之一……盖铅质先走,其铜色渐高。”可见铜钱材质实乃黄铜。下列说法错误的是( )A、黄铜是一种铜锌合金材料,其熔点比纯铜低 B、黄铜与黄金外观相似,制作的钱币均具有耐火性 C、从铸钱过程可以看出,锌的沸点低于铜 D、铜钱不易产生铜绿,由于倭铅保护了铜2. 设 为阿伏加德罗常数的值,下列说法中正确的是( )A、 正离子所含的电子总数为 B、 与 混合气体中所含原子总数为 C、常温常压下, 和 混合气体中含有 个氧原子 D、电解 溶液共得到 气体(标准状况),理论上转移了 个电子3. 下列化学实验操作与对应现象均正确,且能得出对应结论的是( )
实验操作
现象
结论
A
取样品于试管中,加足量 溶液,加热,将湿润的红色石蕊试纸置于试管口
试纸不变色
样品中无
B
向 溶液中加适量铜粉,振荡,滴加 溶液
产生蓝色沉淀
还原性:
C
在 溶液中滴入几滴 溶液,再滴入 溶液
先生成白色沉淀,后变成黄色
溶度积 :
小于
D
将活性炭放入盛有 的锥形瓶中
气体颜色变浅
活性炭有还原性
A、A B、B C、C D、D4. 由 晶体制取无水 的实验装置如下图所示,下列说法错误的是( ) A、装置①制取 用到浓硫酸的吸水性 B、装置②起到干燥 气体的作用 C、操作顺序是先点燃③处酒精灯,再滴入浓盐酸 D、装置④中下层少量 起到防倒吸的作用5. 下列反应对应的离子方程式正确的是( )A、 溶液中滴入稀硝酸: B、小苏打溶液中加入足量澄清石灰水: C、酸性高锰酸钾溶液与稀草酸反应: D、 溶液加入过量 溶液加热:6. 常温下,次氯酸电离平衡体系中各成分的组成分数 为 或 ]与 的关系如图所示。下列有关说法正确的是( )
A、装置①制取 用到浓硫酸的吸水性 B、装置②起到干燥 气体的作用 C、操作顺序是先点燃③处酒精灯,再滴入浓盐酸 D、装置④中下层少量 起到防倒吸的作用5. 下列反应对应的离子方程式正确的是( )A、 溶液中滴入稀硝酸: B、小苏打溶液中加入足量澄清石灰水: C、酸性高锰酸钾溶液与稀草酸反应: D、 溶液加入过量 溶液加热:6. 常温下,次氯酸电离平衡体系中各成分的组成分数 为 或 ]与 的关系如图所示。下列有关说法正确的是( )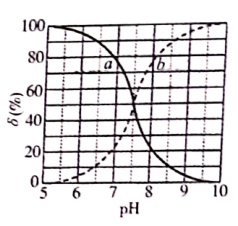 A、次氯酸的电离方程式为 B、曲线 依次表示 、 的变化 C、次氯酸电离常数 的数量级为 D、向次氯酸溶液中加 溶液, 将减小7. 世界某著名学术刊物介绍了一种新型中温全瓷铁-空气电池,其结构如图所示。下列有关该电池放电时的说法正确的是( )
A、次氯酸的电离方程式为 B、曲线 依次表示 、 的变化 C、次氯酸电离常数 的数量级为 D、向次氯酸溶液中加 溶液, 将减小7. 世界某著名学术刊物介绍了一种新型中温全瓷铁-空气电池,其结构如图所示。下列有关该电池放电时的说法正确的是( )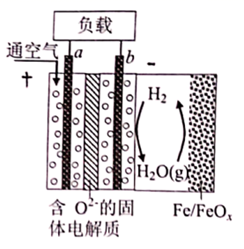 A、a极为原电池的负极 B、正极的电极反应式为 C、放电时电子从b极经固体电解质流向a极 D、消耗掉 铁时,理论上要消耗 标准状况的
A、a极为原电池的负极 B、正极的电极反应式为 C、放电时电子从b极经固体电解质流向a极 D、消耗掉 铁时,理论上要消耗 标准状况的二、非选择题
-
8. 砷 与其化合物被运用在农药、除草剂等。砒霜是传统文化中常提及的剧毒药物,其成分为砷的 价氧化物,但微量的砷对身体有益。回答下列关于砷及其化合物的问题:(1)、砒霜的化学式为。马氏试砷法是鉴定砒霜中毒的常用方法,反应原理为:① 砒霜 ;② ,形成具有金属光泽的黑色砷镜。①反应中 与 的系数比为;②反应中 分解放出 的热量,反应的热化学方程式为。(2)、 是两性氢氧化物,它与盐酸反应的化学方程式为。(3)、成语“信口雌黄”中的雌黄为 ,曾用作绘画颜料。 可与 溶液反应生成 和 ,该反应(填“是”或“不是”)氧化还原反应, 溶液显性。(4)、将 设计成原电池如图所示。反应达到平衡状态时,电流表指针是否偏转?(填“是”或“否”)。此时向左室中加入适量的烧碱溶液,外电路的电流方向是 , 负极的电极反应式为。
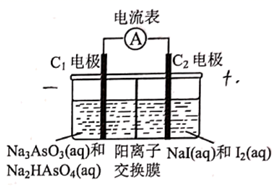 9. 研究 、 等大气污染气体的处理及利用具有重要意义。回答相关问题:
9. 研究 、 等大气污染气体的处理及利用具有重要意义。回答相关问题:已知:①
②
保持温度 不变,在 的刚性容器中充入适量 与 发生反应 达到平衡。从 时的平衡状态升高温度,上述平衡体系中各物质的物质的量随温度的变化如下图所示。
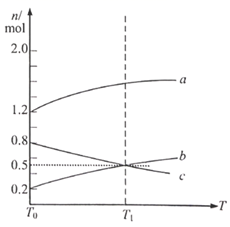 (1)、 ,图中表示 的曲线为 , 0(填“大于”或“小于”)。(2)、从反应开始到平衡这 内用 表示的平均反应速率为;下列能说明反应达到平衡状态的是。
(1)、 ,图中表示 的曲线为 , 0(填“大于”或“小于”)。(2)、从反应开始到平衡这 内用 表示的平均反应速率为;下列能说明反应达到平衡状态的是。A. 与 质量比不再变化 B. 与 的分子总数保持不变
C.混合气体的密度保持不变 D. 的体积分数不再变化
(3)、若温度 时,体系总压强为 ,则此时 气体的分压为(分压=总压×物质的量分数),压强平衡常数为。(4)、为提升 的转化率,除控制温度外,还可采取的措施是(写2条)。10. 高铁酸钾 是一种绿色高效的水处理剂,具有杀菌、消毒、氧化、絮凝、吸附、脱色等多种功能。以下是制取高铁酸钾并探究其性质的相关实验,回答相关问题:
i.在C中加入 和 的浓溶液混合均匀,保持 以下,将A产生的 缓缓通入C中,不断搅拌至溶液呈深紫红色即得 的混合液。
ii.取下C继续加入 固体至饱和,过滤取滤液。
ⅲ.在滤液中加入饱和 溶液,保持温度不变,不断搅拌至有大量黑色沉淀生成,过滤取滤渣。
ⅳ.将滤渣用 溶液溶解,再加入饱和 溶液,冰水冷却析出晶体,过滤后用95%乙醇洗去碱液,再用乙醚洗涤即得到产品。
已知一定条件下, 时相关物质溶解度如下表:
物质
溶解度
36.1
87.3
108.6
112
138.5
38.2
(1)、B装置的作用是;A制取 适合的试剂是(选填编号)。a. (浓) b. (浓)
c. (浓) d. 溶液
(2)、装置C应置于中。(3)、步骤ⅱ加 的目的是沉盐,该盐主要是。(4)、步骤ⅲ加 的反应方程式为。(5)、步骤iv中乙醚洗涤的作用是。(6)、浑浊的城市污水中常含硫化物而发臭,向污水中加入高铁酸钾,静置一会儿后发现污水变澄清臭味消失。请解释原因:。(7)、在同等浓度不同条件下, 溶液的分解率如图所示,据此分析,保存 溶液的适宜条件是。 11. 铝灰主要含有 、 ,以及少量 和 的氧化物,下边是利用铝灰制备净水剂 的工艺流程,回答相关问题:
11. 铝灰主要含有 、 ,以及少量 和 的氧化物,下边是利用铝灰制备净水剂 的工艺流程,回答相关问题: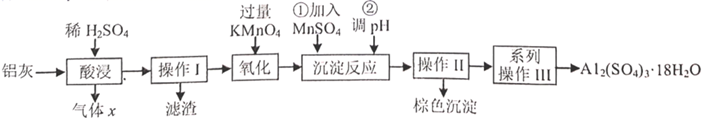
已知:金属离子浓度为 时生成氢氧化物沉淀的
开始沉淀时
3.4
6.3
1.5
完全沉淀时
4.7
8.3
2.8
(1)、气体x的分子式是 , 酸浸充分后溶液中的金属阳离子是。(2)、操作Ⅰ和Ⅱ用到的玻璃仪器有烧杯、玻璃棒、。(3)、加过量 溶液的目的是。(4)、棕色沉淀含 。操作①加入 反应的离子方程式是 , 判断该反应完成的现象是。(5)、操作②调 的范围是。(6)、 可制作聚合硫酸铝 ,它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若 ,则 。引起聚合硫酸铝形态多变的基本成分是 离子,可用实验测定其含量。称取 试样,将其移入锥形瓶中,用移液管加入 盐酸,充分溶解聚合物后,加 氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用 氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液 。则聚合硫酸铝中 的质量分数为。