江西省上饶市2021年高考理综-化学一模试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 生活离不开化学,下列行为不合理或有常识性错误的是( )A、用明矾可消除水中Cu2+等重金属离子污染 B、上饶市在创全国文明城市,为符合题意响应“垃圾分一分,环境美十分”的口号,可把坚果壳放到标有
 图标的垃圾桶内
C、75%(体积分数)的酒精、含氯消毒剂、过氧乙酸均可以有效灭活新型冠状病毒
D、蚕丝和棉纤维灼烧后产生的气味不同
2. 某有机化合物键线式如图所示,有关该有机物说法正确的是( )
图标的垃圾桶内
C、75%(体积分数)的酒精、含氯消毒剂、过氧乙酸均可以有效灭活新型冠状病毒
D、蚕丝和棉纤维灼烧后产生的气味不同
2. 某有机化合物键线式如图所示,有关该有机物说法正确的是( ) A、该有机物的分子式为C7H8O2 B、该有机物最多有15个原子共面 C、1mol该有机物最多能与4molH2发生还原反应 D、室温下该有机物易溶于水3. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、2H2S+SO2=3S↓+2H2O反应中,每生成1mol氧化产物时转移电子数为NA B、物质的量相等的重水与水相差2NA个中子 C、乙烯和丙烯组成的28g 混合气体中含氢原子数为4NA D、pH=13的1LBa(OH)2 溶液中所含有OH-数目为0.2NA4. 化学是以实验为基础的学科,有关下列实验操作中,现象、结论合理的是( )
A、该有机物的分子式为C7H8O2 B、该有机物最多有15个原子共面 C、1mol该有机物最多能与4molH2发生还原反应 D、室温下该有机物易溶于水3. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、2H2S+SO2=3S↓+2H2O反应中,每生成1mol氧化产物时转移电子数为NA B、物质的量相等的重水与水相差2NA个中子 C、乙烯和丙烯组成的28g 混合气体中含氢原子数为4NA D、pH=13的1LBa(OH)2 溶液中所含有OH-数目为0.2NA4. 化学是以实验为基础的学科,有关下列实验操作中,现象、结论合理的是( )选项
实验操作
现象
结论
A
用结净干燥的玻璃棒蘸取浓硫酸点在干燥的pH试纸上
试纸变黑
体现浓硫酸的吸水性
B
将乙醇和浓硫酸混合溶液加热至170℃,将产生的气体通入溴水中
溴水褪色
有乙烯生成
C
某无色溶液滴加盐酸,产生无色气体通入澄清石灰水中
石灰水先变浑浊后变澄清
无色溶液中一定含有CO
D
向2mL0.1mol/LNa2S溶液中滴2滴0.1mol/L ZnSO4溶液,再滴2滴0.1mol/L CuSO4溶液
先生成白色沉淀,后生成黑色沉淀
Ksp(ZnS)与Ksp(CuS)大小无法判定
A、A B、B C、C D、D5. 用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图所示,质子膜允许H+和H2O通过。有关说法正确的是( )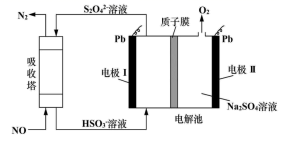 A、电极Ⅰ为电解池的负极,吸收塔反应为2NO+2S2O +2H2O=N2 +4HSO B、电解池中的质子运动方向是:左室→质子膜→右室 C、电极Ⅱ发生的反应为:4OH--4e-=O2↑+2H2O- D、吸收塔中每处理1molNO则右室会生成11.2L的O26. 位于三个不同周期的五种短周期主族元素F、W、X、Y、Z,其中W、Y、Z分别位于三个不同周期,F、Y位于同一主族;Y原子的最外层电子数是W原子的最外层电子数的2倍;W、X、Y三种简单离子的核外电子排布相同。由W、X、Y、Z形成的某种化合物的结构如图所示,下列说法正确的是( )
A、电极Ⅰ为电解池的负极,吸收塔反应为2NO+2S2O +2H2O=N2 +4HSO B、电解池中的质子运动方向是:左室→质子膜→右室 C、电极Ⅱ发生的反应为:4OH--4e-=O2↑+2H2O- D、吸收塔中每处理1molNO则右室会生成11.2L的O26. 位于三个不同周期的五种短周期主族元素F、W、X、Y、Z,其中W、Y、Z分别位于三个不同周期,F、Y位于同一主族;Y原子的最外层电子数是W原子的最外层电子数的2倍;W、X、Y三种简单离子的核外电子排布相同。由W、X、Y、Z形成的某种化合物的结构如图所示,下列说法正确的是( ) A、W、F、X的最高价氧化物的水化物两两不能发生反应 B、因为Y比F的氢化物稳定,所以Y的氢化物沸点高于F C、X与Y、Y与Z形成原子个数比1:1的化合物中,所含化学键类型完全相同 D、W元素所在周期的主族元素简单离子半径比较中,W的离子半径最小7. 常温下,以酚酞作指示剂,用0.1mol/L的NaOH溶液滴定20.00mL0.1mol/L的二元酸H2A溶液。溶液中pH、分布系数δ 随滴加NaOH溶液体积V(NaOH)的变化关系如图所示,有关说法正确的是 ( )
A、W、F、X的最高价氧化物的水化物两两不能发生反应 B、因为Y比F的氢化物稳定,所以Y的氢化物沸点高于F C、X与Y、Y与Z形成原子个数比1:1的化合物中,所含化学键类型完全相同 D、W元素所在周期的主族元素简单离子半径比较中,W的离子半径最小7. 常温下,以酚酞作指示剂,用0.1mol/L的NaOH溶液滴定20.00mL0.1mol/L的二元酸H2A溶液。溶液中pH、分布系数δ 随滴加NaOH溶液体积V(NaOH)的变化关系如图所示,有关说法正确的是 ( )已知:A2−的分布系数为
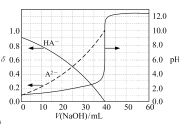 A、当V(NaOH)=0mL时,c(H2A)>c(HA- )>c(A2- )>c(H+)>c(OH- ) B、当V(NaOH)=20.00mL时,c(Na+)<c(HA- )+2c(A2- ) C、室温下,HA-的电离常数值为1.0×10-5 D、当V(NaOH)=40.00mL时, c(HA -)+c(H+)=c(A2- )+c(OH- )
A、当V(NaOH)=0mL时,c(H2A)>c(HA- )>c(A2- )>c(H+)>c(OH- ) B、当V(NaOH)=20.00mL时,c(Na+)<c(HA- )+2c(A2- ) C、室温下,HA-的电离常数值为1.0×10-5 D、当V(NaOH)=40.00mL时, c(HA -)+c(H+)=c(A2- )+c(OH- )二、非选择题
-
8. PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如表:
熔点/℃
沸点/℃
密度/g/mL
化学性质
黄磷
44.1
280.5
1.82
2P+3Cl2 (少量) 2PCl3
2P+5Cl2 (过量) 2PCl5
PCl3
-112
75.5
1.574
遇水生成H3PO3和HCl,遇氧气生成POCl3
(1)、Ⅰ.PCl3的制备如图是实验室制备PCl3的装置(部分仪器已省略)。

回答下列问题:
通入仪器甲中的冷却水从(填“M”或 “N”)口出来;仪器乙为下端浸在冷水中的仪器,乙的名称为。
(2)、检查装置气密性并装入药品后,先关闭K1 , 打开K2通入干燥的CO2 , 一段时间后,关闭K2 , 加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。通干燥CO2的作用是。(3)、实验室利用A装置制备Cl2的离子方程式为;实验过程中,通入氯气的速率不宜过快的原因是。(4)、II.测定PCl3的纯度测定产品中PCl3纯度的方法如下:迅速称取4.400g产品,水解完全后配成500mL溶液,取出25.00mL加入过量0.1000mol/L20.00mL碘溶液,充分反应后再用0.1000mol/LNa2S2O3溶液滴定过量的碘,终点时消耗12.00mLNa2S2O3溶液。已知:H3PO3+H2O+I2 =H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6 , 假设测定过程中没有其他反应。
根据上述数据,该产品中PCl3的质量分数为 [已知:M(PCl3)=137.5g/mol];若滴定终点时仰视读数,则PCl3的质量分数(填“偏大”、“偏小”或“无影响”)。
(5)、Ⅲ.PCl3水解生成的H3PO3性质探究请你设计一个实验方案,证明H3PO3为二元酸:。
9. 2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂,但其稳定性较差,可转化为较稳定的NaClO2保存。工业上常用吸收法和电解法制备NaClO2 , 其工艺流程示意图如图1。

已知:a.纯ClO2熔点为-59℃,沸点为11℃ ,纯的ClO2受热或遇光易发生爆炸,一般稀释到10%以下。
b.长期放置或高于60℃时,NaClO2易分解生成NaClO3和NaCl。
(1)、步骤1中,生成ClO2的化学方程式是 , 通入空气的作用是 。(2)、方法1中,反应的离子方程式是 , 利用方法1制NaClO2时,温度不能超过35℃,可能的原因是 。(3)、方法2中,NaClO2在生成(选填“阴极”或“阳极”)。(4)、NaClO2的溶解度曲线如图2所示,步骤3从NaClO2溶液中获得NaClO2的操作是:加热温度至略低于60℃、、 , 过滤、洗涤、干燥。(5)、保存液态ClO2的条件是(填字母)。a.常温、密封、不避光 b.低温、密封、避光 c.常温、敞口、避光 d.低温、敞口、不避光
(6)、ClO2 在杀菌的同时,可将剧毒氰化物氧化成无毒气体,ClO2 被还原为Cl-。某工厂污水中含CN- a mg/L,处理10m3这种污水,至少需要ClO2 mol。10. 氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:(1)、肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知6.4g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量122.5kJ,则该反应的热化学方程式为。(2)、尾气中的NO2与足量的空气充分混合入,通入烧碱溶液中。该反应的离子方程式为。(3)、在773K时,分别将2.00molN2和6.00molH2充入一个固定容积为1L的密闭容器中发生反应生成NH3 , 气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。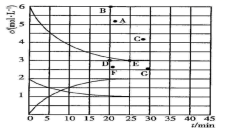
①该温度下,若向同容积的另一容器中投入N2、H2、NH3 , 其浓度均为2mol/L,则此时v正v逆(填“大于”或“小于”或“等于”)。
②在此温度下,若起始向一个固定容积为1L的密闭容器中充入4molN2和12molH2 , 则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为。
(4)、在373K时,向体积为2L的恒容真空容器中充入1.00molNO2 , 发生如下反应: 2NO2(g) N2O4(g)△H=﹣56.9kJ•mol﹣1测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如表:t/min
0
20
40
60
80
φ(NO2)
1.0
0.75
0.58
0.50
0.50
已知该反应V正(NO2)=K1·c2(NO2),V逆(N2O4)= K2·c(N2O4)其中k1、k2为速率常数,则373K时, =。
(5)、如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时, O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。N2H4的电子式为 , 该燃料电池的负极反应式为。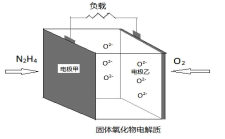 11. S、Se 、N、Fe等元素及其化合物在科学研究和工业生产中具有重要的作用。(1)、臭鼬排放的臭气主要成分为3﹣MBT,键线式如图所示:
11. S、Se 、N、Fe等元素及其化合物在科学研究和工业生产中具有重要的作用。(1)、臭鼬排放的臭气主要成分为3﹣MBT,键线式如图所示:
0.1mol 3﹣MBT中含有σ键数目为(NA为阿伏加德罗常数的值)。3﹣MBT的沸点低于(CH3)2C=CHCH2OH,主要原因是。
(2)、2020年12月17日,采撷月壤的嫦娥五号荣耀归来。嫦娥五号探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质。硒为第四周期第VIA族元素,其氧化物有SeO2和SeO3两种,SeO3分子的立体构型为 , 与其互为等电子体的阴离子为 (举一例)。(3)、铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。①K3[Fe(CN)6]中所涉及的各元素的第一电离能由大到小的顺序为。
②(CN)2分子中存在碳碳键,C原子的杂化轨道类型为。
③下列选项是部分同学画的基态氮原子的核外电子排布图,其中违背泡利原理的是 (填序号,下同),违背洪特规则的是。
A.
 B.
B. 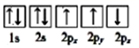 C.
C. 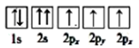 (4)、如图是金属铁晶体中的一个晶胞。
(4)、如图是金属铁晶体中的一个晶胞。
①该晶体中原子总体积占晶体体积的比值为(用含π的最简代数式表示)。
②铁原子的半径为rpm,其晶体密度为g•cm﹣3(用含有r、NA的最简代数式表示)。
12. 某研究小组以下列路线合成乙酰基扁桃酰氯。
已知:①

②RCN
 RCOOH
RCOOH ③RCOOH RCOCl RCOOR’
(1)、有机物 B的名称为。(2)、B生成C的化学反应方程式。(3)、物质 D 的结构简式是。(4)、下列说法错误的是___________ 。A、有机物A能发生取代反应和消去反应 B、乙酰基扁桃酰氯属于芳香族化合物 C、化合物 C 能与新制的 Cu(OH)2发生反应(5)、E+F→G 的化学方程式是。(6)、化合物 D 有多种同分异构体,同时符合下列条件的同分异构体共有种,写出其中一种核磁共振氢谱峰的面积比为1:2:2:2的同分异构体的结构简式:。①氰基(-CN)接在苯环 ②能与金属钠反应
(7)、设计以乙醇为原料制备乳酸(α-羟基丙酸)的合成路线(用流程图表示;无机试剂任选)。