黑龙江省齐齐哈尔市2021年高考理综-化学一模试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 古籍中记载的下列事实或现象的形成,未涉及氧化还原反应的是( )A、《梦溪笔谈》:“石穴中水,所滴者皆为钟乳” B、《神农本草经》:“空青(蓝铜矿类)…能化铜铁鉉(铅)锡作金” C、《本草纲目》:“野外之鬼磷,其火色青,其状如炬,俗称鬼火…” D、《本草经疏》:“丹砂(HgS),味甘微寒而无毒…若经伏火…,则毒等砒硇,服之必毙”2. 某白色固体混合物由NaOH、K2CO3、BaCl2、KAl(SO4)2∙12H2O中的两种物质组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色反应,通过钴玻璃可观察到紫色;③向溶液中加少量盐酸,产生白色沉淀。根据实验现象可判断其组成为( )A、NaOH、K2CO3 B、NaOH、KAl(SO4)2∙12H2O C、K2CO3、BaCl2 D、BaCl2、KAl(SO4)2∙12H2O3. 有机合成中间体X的结构简式如图所示。下列有关X的说法正确的是( )
 A、分子式为C8 H10O4 B、能与NaHCO3反应生成CO2 C、不能使酸性KMnO4溶液褪色 D、分子中所有原子可能共平面4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是内层电子数的2倍,Y是地壳中含量最多的元素,Z元素的金属性在短周期中最强,W与Y位于同一主族。下列说法正确的是( )A、简单离子半径:Y<Z< W B、Y与Z组成的化合物中不可能含共价键 C、X的简单气态氢化物的热稳定性比Y的弱 D、X的最高价氧化物对应水化物的酸性比W的强5. 甲醇羰基化反应制备乙酸的转化关系如图所示。下列说法错误的是( )
A、分子式为C8 H10O4 B、能与NaHCO3反应生成CO2 C、不能使酸性KMnO4溶液褪色 D、分子中所有原子可能共平面4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是内层电子数的2倍,Y是地壳中含量最多的元素,Z元素的金属性在短周期中最强,W与Y位于同一主族。下列说法正确的是( )A、简单离子半径:Y<Z< W B、Y与Z组成的化合物中不可能含共价键 C、X的简单气态氢化物的热稳定性比Y的弱 D、X的最高价氧化物对应水化物的酸性比W的强5. 甲醇羰基化反应制备乙酸的转化关系如图所示。下列说法错误的是( ) A、总反应方程式为 B、 、 是该转化过程中的催化剂 C、物质间转化过程中需要不断补充水 D、若总反应放出热量,则断裂化学键吸收总能量小于形成化学键放出总能量6. 锌-空气燃料电池(ZAFC)具有携带方便、成本低及安全无污染等优点,在离网电源及汽车电源的应用上具有广阔的前景。我国研制的新型锌-空气燃料电池工作原理如图所示,下列说法错误的是( )
A、总反应方程式为 B、 、 是该转化过程中的催化剂 C、物质间转化过程中需要不断补充水 D、若总反应放出热量,则断裂化学键吸收总能量小于形成化学键放出总能量6. 锌-空气燃料电池(ZAFC)具有携带方便、成本低及安全无污染等优点,在离网电源及汽车电源的应用上具有广阔的前景。我国研制的新型锌-空气燃料电池工作原理如图所示,下列说法错误的是( )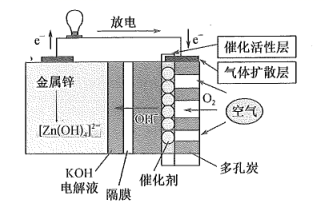 A、放电时,负极反应为Zn+4OH- -2e-=[Zn(OH)4]2- B、充电时,电解质溶液中c(OH)-逐渐增大 C、放电时,当负极减少6. 5 g,通过隔膜的电子个数约为1.204×1023 D、多孔炭可增大电极与电解质溶液的接触面积,也有利于O2扩散至电极表面7. 常温下,向0.01 mol∙L-1的一元酸HX溶液中通入氨气,此过程混合溶液中 与pH之间关系如图所示(忽略溶液的体积变化)。下列叙述正确的是( )
A、放电时,负极反应为Zn+4OH- -2e-=[Zn(OH)4]2- B、充电时,电解质溶液中c(OH)-逐渐增大 C、放电时,当负极减少6. 5 g,通过隔膜的电子个数约为1.204×1023 D、多孔炭可增大电极与电解质溶液的接触面积,也有利于O2扩散至电极表面7. 常温下,向0.01 mol∙L-1的一元酸HX溶液中通入氨气,此过程混合溶液中 与pH之间关系如图所示(忽略溶液的体积变化)。下列叙述正确的是( )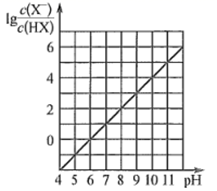 A、pH=7时,溶液中c( )= mol∙L-1 B、常温下,K(HX)≈1×10- 5 C、当溶液为碱性时,c(X- )<c(HX) D、混合溶液中不可能在:c(X-)>c( )>c(H+)>c(OH-)
A、pH=7时,溶液中c( )= mol∙L-1 B、常温下,K(HX)≈1×10- 5 C、当溶液为碱性时,c(X- )<c(HX) D、混合溶液中不可能在:c(X-)>c( )>c(H+)>c(OH-)二、非选择题
-
8. 由含锌废料(主要含ZnO、PbO、CuO及少量FeO、MnO)生产锌及氧化锌的流程如图所示:
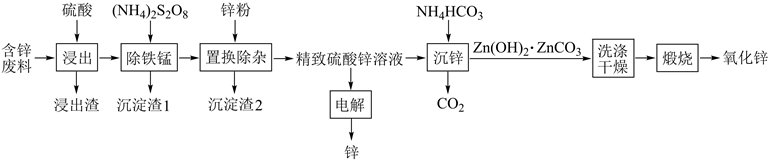
回答下列问题:
(1)、浸出渣主要成分为(填化学式,下同) ;沉淀渣2为。(2)、“除铁锰"”时,Mn(II)氧化生成MnO2( 转化为 ),配平该反应的离子方程式Mn2++ +H2O=MnO2↓+ +H+ , 。(3)、“沉锌”时,反应的化学方程式为;检验Zn(OH)2∙ZnCO3已洗涤干净的方法是。(4)、“电解”中产生(填化学式)可在(填操作单元名称)中循环利用。(5)、将Zn(OH)2∙ZnCO3加热分解可得到具有催化性能的活性氧化锌,若加热过程中固体质量减少了6. 2 kg,则理论上生成kg氧化锌。9. Na2FeO4是一种重要的高效消毒剂,主要应用于饮用水处理。已知:①Cl2+ 2OH- =ClO- +Cl- +H2O是放热反应;
②NaClO遇热水生成NaClO3;
③Na2FeO4为紫色固体,微溶于NaOH溶液,不溶于乙醇;具有强氧化性,在酸性或中性溶液中快速产生O2 , 在碱性溶液中较稳定。
回答下列问题:
(1)、制备NaClO装置如图所示:
仪器a中盛放的试剂为(填名称) ,装置C置于冰水浴中,若温度过高,其离子方程式为;若撤去B装置,则装置C中NaOH恰好完全反应时的溶液中n(NaCl):n(NaClO)为 (填字母)。本套实验装置的缺陷是。
a.1:1 b.>1:1 c.<1:5 d.1:5
(2)、合成Na2FeO4:利用NaClO强碱性溶液与Fe(NO3)3溶液在0~5℃反应制备Na2FeO4 , 装置如图。实验中通过仪器a缓慢滴加的溶液是 , 原因是 , 三颈烧瓶中。合成Na2FeO4的离子方程式是 , 从三颈烧瓶中获得晶体的系列操作是结晶、过滤洗涤、干燥,其中洗涤剂可以是(填化学式)。 (3)、探究Na2FeO4性质:取少量Na2FeO4溶液于试管中,加入H2O2、稀H2SO4 , 观察到溶液由紫红色逐渐变为黄色,并收集到无色气体,该无色气体为(填化学式) ,若反应转移1 mol e- , 则生成L(标准状况下)无色气体。10. 在煤化工领域主要涉及碳一化学,即研究以含有一个碳原子的物质(CO、CO2、CH4、CH3OH等)为原料合成化工产品或液体燃料。回答下列问题:(1)、已知物质之间转化能量关系如图所示:
(3)、探究Na2FeO4性质:取少量Na2FeO4溶液于试管中,加入H2O2、稀H2SO4 , 观察到溶液由紫红色逐渐变为黄色,并收集到无色气体,该无色气体为(填化学式) ,若反应转移1 mol e- , 则生成L(标准状况下)无色气体。10. 在煤化工领域主要涉及碳一化学,即研究以含有一个碳原子的物质(CO、CO2、CH4、CH3OH等)为原料合成化工产品或液体燃料。回答下列问题:(1)、已知物质之间转化能量关系如图所示: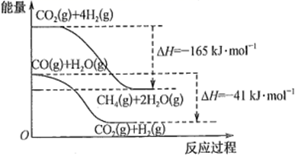
写出CO(g)和H2(g)生成CH4(g)和H2O(g)的热化学方程式。
(2)、煤化工业上主要利用CO和H2反应制备甲醇(CH3OH),反应热化学方程式为CO(g)+2H2(g)=CH3OH(g) △H。已知CO的平衡转化率与温度的关系如图所示: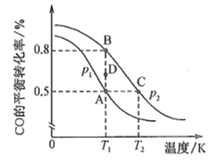
①该反应的∆H(填“>”“<”或“=”)0。
②A、B、C三点平衡常数KA . KB、KC的大小关系为。压强p1 (填“>”“<”或“=”,下同)p2 , 在T1和p2条件下,由D点到B点过程中,正、逆反应速率之间的关系:v正v逆。
③若容器容积不变,则下列措施可提高CO平衡转化率的是(填字母)。
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
④在2L恒容密闭容器中充人2molCO和4molH2 , 在p2和T1条件下经10min达到平衡状态。在该条件下,v(H2)=mol∙L-1∙min-1;平衡常数K =(填数值)。
(3)、用H2还原CO2可以合成CH3OH: CO2(g) + 3H2(g)⇌CH3OH(g) +H2O(g) ∆H. 恒压下,CO2和H2的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为。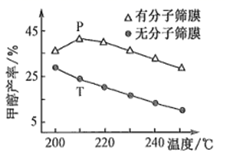 (4)、CO2的再利用技术是促进可持续发展的措施之一,CO2电化法制甲酸的工艺原理如图所示。阴极电极反应式为。
(4)、CO2的再利用技术是促进可持续发展的措施之一,CO2电化法制甲酸的工艺原理如图所示。阴极电极反应式为。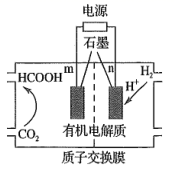 11. 铬及其化合物用途广泛。回答下列问题:(1)、基态Cr原子价电子排布式为 , 有个未成对电子。(2)、重铬酸铵[(NH4)2Cr2O7]为桔黄色单斜结晶,常用作有机合成催化剂, 的结构如图。(NH4)2Cr2O7 中N、O、Cr三种元素第一电离能由大到小的顺序是(填元素符号),1 mol该物质中含σ键的数目为NA
11. 铬及其化合物用途广泛。回答下列问题:(1)、基态Cr原子价电子排布式为 , 有个未成对电子。(2)、重铬酸铵[(NH4)2Cr2O7]为桔黄色单斜结晶,常用作有机合成催化剂, 的结构如图。(NH4)2Cr2O7 中N、O、Cr三种元素第一电离能由大到小的顺序是(填元素符号),1 mol该物质中含σ键的数目为NA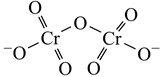 (3)、铬能形成多种配合物。
(3)、铬能形成多种配合物。①配合物a、b、c的化学式如下:
a, [Cr(H2O)4Cl2]Cl∙2H2O b. [Cr(H2O)5Cl]Cl2∙H2O c. [Cr(H2O)6 ]Cl3
相同物质的量的a、b、c分别与足量AgNO3溶液反应,生成AgCl的物质的量之比为。
②Reinecke salt的结构如图所示:
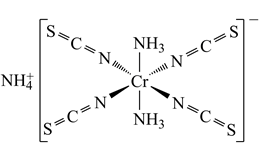
其中配位原子为(填元素符号);阳离子的空间结构为 , NCS-中碳原子杂化方式为。
(4)、一种半金属磁体的结构如图所示,其晶胞参数为a pm。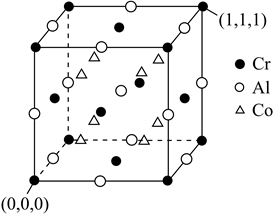
①距离每个Cr最近的Al有个,距离Cr(0,0,0)最近的Co的原子坐标为。
②该晶体的密度为g∙cm-3(NA表示阿伏加德罗常数的值)。
12. 双香豆素可用于血栓栓塞性疾病的预防和治疗。以芳香化合物A为原料合成其中间体H的一种合成路线如下:
已知:①RCH2OH RCHO
②
 (R为烃基,X为卤素)
(R为烃基,X为卤素)③MOMCl表示CH3OCH2Cl。
回答下列问题:
(1)、A的化学名称为;(2)、B的结构简式为;(3)、由C生成D的化学方程式为;(4)、E的分子式为 , 由E生成F的反应类型是。(5)、G中官能团名称有(酚)羟基、。(6)、M为H的同分异构体,同时符合下列条件的有种(不包括立体异构) ,其中仅含三种化学环境氢的结构简式是A.含有
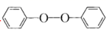 结构
结构 B.除“—O—O—”外含有一种官能团
C.能与NaHCO3溶液反应