广西桂林、崇左市2021年高考理综-化学二模试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 化学与人类生活、生产和社会可持续发展密切相关,下列有关说法错误的是( )A、燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 B、中国华为自主研发的5G芯片巴龙5000的主要材料是Si C、N95口罩的主要材质聚丙烯叮利用丙烯加聚合成 D、国产新冠灭活疫苗需冷冻保存以防发生变性2. 阿司匹林是家中常备药,它对血小板的聚集有抑制作用,早在1853年夏尔弗雷德里克,热拉尔(Gerhard1)就用水杨酸与乙酸酐合成了乙酰水杨酸(阿司匹林),原理如下。下列说法错误的是( )
 A、该反应的类型是取代反应 B、阿司匹林的分子式为C9H8O4 C、阿司四林不能溶于NaOH溶液中 D、水杨酸分子的所有原子可能共平面3. 下列实验方案中,能达到实验目的是( )
A、该反应的类型是取代反应 B、阿司匹林的分子式为C9H8O4 C、阿司四林不能溶于NaOH溶液中 D、水杨酸分子的所有原子可能共平面3. 下列实验方案中,能达到实验目的是( )实验目的
实验方案
A
验证H2O2具有氧化性
向0.1 mol·L-1 KMnO4溶液中滴加0.1 mol·L-1H2O2溶液,可观察到溶液褪色
B
证明铜与浓硫酸反应有SO2生成
将浓硫酸滴加到放有铜片的试管中,并将蘸有品红溶液的湿滤纸置于试管口
C
比较Ksp(AgI)与Ksp(AgCl) 的大小关系
向浓度均为0.05mol·L-1的NaI、NaCl混合溶液中滴加足量AgNO3溶液,观察所产生沉淀的颜色
D
确定NaCl溶液中是否混有Na2CO3
取少量待测液,滴加CaCl2溶液,观察是否出现白色浑浊
A、A B、B C、C D、D4. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、0.1 mol•L-1NH4NO3溶液中含有的氮原子总数为0.2NA B、12g石墨和金刚石的混合物含有4NA个碳原子 C、1molCl2与足量铁充分反应,转移的电子数为2NA D、2.8gCO 和C2H4的混合气体中含有的质子数为1.4NA5. 一种新型的锂-空气电池的工作原理如图所示。关于该电池的说法中正确的是( )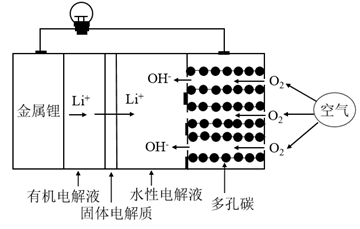 A、电池总反应为4Li+O2+2H2O=4LiOH B、可将有机电解液改为水溶液 C、金属锂作正极,发生氧化反应 D、当有22.4LO2被还原时,溶液中有4mol Li+向多孔碳电极移动6. A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期。X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示。下列说法正确的是( )
A、电池总反应为4Li+O2+2H2O=4LiOH B、可将有机电解液改为水溶液 C、金属锂作正极,发生氧化反应 D、当有22.4LO2被还原时,溶液中有4mol Li+向多孔碳电极移动6. A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期。X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示。下列说法正确的是( ) A、离子半径:C >D>B B、化合物Y中既有离子键又有共价键 C、电解熔融状态下的化合物Z,可制备D的单质 D、往X溶液中逐滴滴入W溶液,现象是:先产生沉淀,后沉淀溶解7. 常温下,对于pH=9的CH3COONa溶液,下列说法错误的是( )A、该溶液中: c(OH-)>c(CH3COOH)+c(H+) B、往该溶液中滴加醋酸,可能出现c(Na+) <c(CH3COO- ) C、往该溶液中通入HCl气体, 保持不变 D、相同温度下,该CH3COONa溶液的浓度大于pH=9的NaOH溶液的浓度
A、离子半径:C >D>B B、化合物Y中既有离子键又有共价键 C、电解熔融状态下的化合物Z,可制备D的单质 D、往X溶液中逐滴滴入W溶液,现象是:先产生沉淀,后沉淀溶解7. 常温下,对于pH=9的CH3COONa溶液,下列说法错误的是( )A、该溶液中: c(OH-)>c(CH3COOH)+c(H+) B、往该溶液中滴加醋酸,可能出现c(Na+) <c(CH3COO- ) C、往该溶液中通入HCl气体, 保持不变 D、相同温度下,该CH3COONa溶液的浓度大于pH=9的NaOH溶液的浓度二、非选择题
-
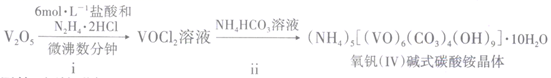
8. 二氧化钒(VO2)是一种新型热敏材料,+4 价的钒化合物在弱酸性条件下易被氧化。实验室以V2O5为原料合成用于制备VO2的氧钒( IV )碱式碳酸铵晶体。过程如下:
回答下列问题:
(1)、步骤i中生成VOCl2的同时还产生一种无色无污染的气体,所发生反应的化学方程式为。只用浓盐酸与V2O5反应也能制备VOCl2溶液,从安全与环保角度分析,该反应不被推广的主要原因是。(2)、步骤ii可在下图装置中进行。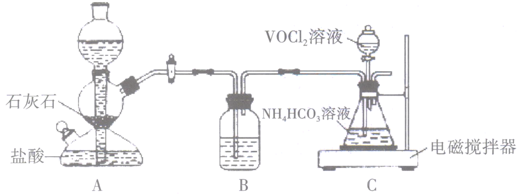
①向锥形瓶中滴加VOCl2溶液前应通入一段时间的CO2 , 目的是。
②装置B中的试剂是。
③反应结束后,将锥形瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和NH4HCO3溶液洗涤除去的阴离子主要是 , 用无水乙醇洗涤的目的是。
(3)、测定氧钒(IV )碱式碳酸铵晶体粗产品中钒的含量。称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L KMnO4溶液至稍过量,充分反应后继续加1%NaNO2溶液至稍过量。再用尿素除去过量的NaNO2 , 滴入几滴铁氰化钾{K3[ Fe(CN)6]}溶液,最后用c mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。滴定反应为: +Fe2++2H+=VO2++Fe3++H2O
①KMnO4溶液的作用是
②滴定终点时的现象为
③粗产品中钒的质量分数的表达式为
9. 黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂)。一种制备黄血盐的工艺如下: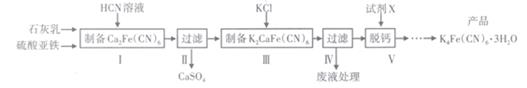
回答下列问题:
(1)、步骤I反应的化学方程式为(2)、步骤Ⅳ过滤所得的废液中含量较多的溶质为(填化学式)。(3)、步骤V是将难溶的K2CaFe(CN)6与X反应脱钙生成K4Fe(CN)6 , 所用的试剂X是(填名称)(4)、工艺中用到有毒的HCN溶液,含CN-的废水必须处理后才能排放。可用两段氧化法处理:第一次氧化: NaCN与NaClO反应,生成NaOCN和NaCl;
第二次氧化: NaOCN与NaClO反应,生成N2和两种盐(其中一种为酸式盐)。
已知HCN是一种苦杏仁味的无色剧毒液体(常温时,Ka=6.3×10-10),易挥发;HCN、HOCN中N元素的化合价相同。
①第一次氧化时,溶液应调节为 (填 “酸性”“碱性 ”或“中性"), 原因是。
②第二次氧化反应的离子方程式为
③常温下,0.1 mol•L-1 HCN溶液中,c(H+)=(列出计算式)。
10. 研究SO2尾气的处理及回收利用具有重要意义。(1)、I.SO2尾气的处理一种煤炭脱硫技术是把硫元素以CaSO4的形式固定下来可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率。相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s) +SO2(g)+CO2(g) △H1= +210.5kJ•mol-1
② CaSO4(s)+CO(g) CaS(s)+CO2(g) △H2=-47.3 kJ•mol-1
反应CaO(s)+ 3CO(g) +SO2(g) CaS(s)+3CO2(g) △H3kJ•mol-1 , 平衡时增大压强,此反应将(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(2)、反应①②的平衡常数的对数lgK随温度的变化曲线如图,其中曲线I代表反应 (填“①”或“②”),从减少SO2排放的角度来考虑,本体系适宜的反应条件是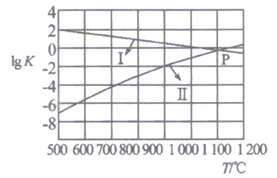
A.低温低压 B.低温高压 C.高温高压 D.高温低压
(3)、另一种方法是用氨水将SO2转化为(NH4)2SO3 , 再氧化为 (NH4)2SO4. , 用空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是。(NH4)2SO4溶液中离子浓度的大小关系为。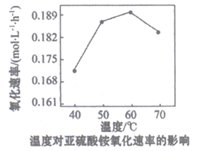 (4)、II.SO2的回收利用
(4)、II.SO2的回收利用SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g) +Cl2(g) SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压密闭容器中发生上述反应,SO2的转化率与温度T的关系如图所示:
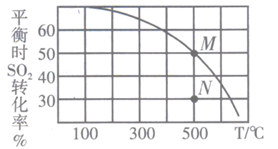
①该反应的平衡常数K(100℃)K(300℃) (填“大于”、“小于”或“等于”);在500℃下,若反应进行至N点,此时v正v逆(填“大于”、“小于”或“等于”)。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp= (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
11. 硫及其化合物有许多用途。请回答下列问题。(1)、基态硫原子的价电子排布式为 , 其电子占据最高能级的电子云轮廓图形状为(2)、常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点由高到低的顺序依次为 , 原因是。(3)、炼铜原料黄铜矿中铜的主要存在形式是CuFeS2 , 煅烧黄铜矿生成SO2 , CuFeS2中存在的化学键类型是 , SO2中心原子的价层电子对数为。(4)、方铅矿(即硫化铅)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于(填“极性”或“非极性”)分子,其中心原子的杂化方式为。下列分子的空间构型与H2S相同的有A. H2O B. CO2 C. SO2 D. CH4
(5)、方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的空隙中。已知晶体密度为 g•cm-3 , 阿伏加德罗常数的值为NA , 则晶胞中硫离子与铅离子最近的距离为nm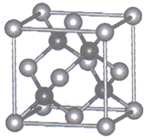 12. 烃A是基本有机化工原料,其分子式为C3H6.由A制备聚合物C和
12. 烃A是基本有机化工原料,其分子式为C3H6.由A制备聚合物C和 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。 
已知:

 ,R-C N RCOOH(1)、A→D的反应类型为;B中含氧官能团名称为;G的结构简式为。(2)、碳原子上连有4个不同的原子或原子团时,该碳称为手性碳化合物
,R-C N RCOOH(1)、A→D的反应类型为;B中含氧官能团名称为;G的结构简式为。(2)、碳原子上连有4个不同的原子或原子团时,该碳称为手性碳化合物 中所含手性碳原子的数目为。 (3)、E→F的化学方程式为。(4)、写出符合下列条件的B的同分异构体的结构简式:
中所含手性碳原子的数目为。 (3)、E→F的化学方程式为。(4)、写出符合下列条件的B的同分异构体的结构简式:①与B具有相同官能团且能发生银镜反应:
②核磁共振氮谱有3组峰,且峰面积之比为6:1:1
(5)、等物质的量的 分别与足量NaOH、 NaHCO3反应,消耗NaOH、NaHCO3的物质的量之比为;检验
分别与足量NaOH、 NaHCO3反应,消耗NaOH、NaHCO3的物质的量之比为;检验  中含有碳碳双键的实验方法是。 (6)、根据题中信息,写出以甲苯为有机原料制备苯乙酸的合成路线(无机试剂任选)。
中含有碳碳双键的实验方法是。 (6)、根据题中信息,写出以甲苯为有机原料制备苯乙酸的合成路线(无机试剂任选)。