新疆乌鲁木齐地区2021年高考化学一模试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 中国人民在悠久的历史中创造了绚丽多彩的中华文化,下列说法错误的是( )A、“木活字”是由元代王祯创制的用于印刷的活字,“木活字”的主要成分是纤维素 B、“苏绣”是用蚕丝线在丝绸或其他织物上绣出图案的工艺,蚕丝的主要成分是蛋白质 C、“鹳鱼石斧图”彩陶缸是我国出土的一件珍贵历史文物,彩陶缸的主要成分是硅酸盐 D、“黑芝麻糊”是一道传统美食,食用时可加入白砂糖作配料,白砂糖的主要成分是麦芽糖2. 能和银氨溶液反应,出现银镜现象的是( )A、乙烯 B、苯 C、甲醛 D、乙酸乙酯3. 下列说法错误的是( )A、水玻璃、硅胶、汽油、漂粉精都是混合物 B、浓氨水中滴加FeCl3溶液可制得Fe(OH)3胶体 C、硅酸盐Ca2Mg5Si8O22(OH)2可用氧化物的形式表示为:2CaO·5MgO·8SiO2·H2O D、电解质溶液导电,电能转化为化学能4. 下列过程与“盐类的水解平衡”或“难溶电解质的溶解平衡”无关的是( )A、将NaOH溶液加入NaHSO4溶液中使其转化为Na2SO4 B、将TiCl4加入水中并加热使其转化为TiO2•xH2O C、将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3 D、将Na2S溶液加入含Hg2+的废水中使其转化为HgS沉淀5. 下列反应属于加成反应的是( )A、CH3﹣CH=CH2+Cl2 CH2Cl﹣CH=CH2+HCl B、CH3COOH+CH3OH CH3COOCH3+H2O C、C2H5Cl+NaOH CH2=CH2↑+NaCl+H2O D、
 +3Cl2
+3Cl2  6. 设NA表示阿伏加德罗常数的值。下列叙述错误的是( )A、标准状况下,2.24LN2和O2的混合气体中,分子数目为0.1NA B、常温常压下,16gCH4含有的共价键数月为4NA C、Na2O与Na2O2的混合物共1mol,阴离子的数目为NA D、氨水溶液中NH 的物质的量为1×10-3mol,则该溶液中含有OH-的数目为1×10-3NA7. 化学式为C3H7FO的物质,含有羟基的同分异构体数目为(不考虑空间异构)( )A、4种 B、5种 C、6种 D、7种8. 下列离子方程式正确的是( )A、浓烧碱溶液中加入铝片:Al+2OH-=AlO +H2↑ B、金属钠投入硫酸铜溶液中:2Na+Cu2+=2Na++Cu C、碳酸氢钙溶液和氢氧化钠溶液混合:HCO +OH-=CO +H2O D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO +CO2+2H2O=Al(OH)3↓+HCO9. 完成下列实验所选择的装置或仪器(夹持装置部分已略去)正确的是( )A、分离Na2CO3溶液和CH3CH2OH
6. 设NA表示阿伏加德罗常数的值。下列叙述错误的是( )A、标准状况下,2.24LN2和O2的混合气体中,分子数目为0.1NA B、常温常压下,16gCH4含有的共价键数月为4NA C、Na2O与Na2O2的混合物共1mol,阴离子的数目为NA D、氨水溶液中NH 的物质的量为1×10-3mol,则该溶液中含有OH-的数目为1×10-3NA7. 化学式为C3H7FO的物质,含有羟基的同分异构体数目为(不考虑空间异构)( )A、4种 B、5种 C、6种 D、7种8. 下列离子方程式正确的是( )A、浓烧碱溶液中加入铝片:Al+2OH-=AlO +H2↑ B、金属钠投入硫酸铜溶液中:2Na+Cu2+=2Na++Cu C、碳酸氢钙溶液和氢氧化钠溶液混合:HCO +OH-=CO +H2O D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO +CO2+2H2O=Al(OH)3↓+HCO9. 完成下列实验所选择的装置或仪器(夹持装置部分已略去)正确的是( )A、分离Na2CO3溶液和CH3CH2OH B、除去Cl2中含有的少量HCl
B、除去Cl2中含有的少量HCl  C、做SO2与NaOH溶液的喷泉实验
C、做SO2与NaOH溶液的喷泉实验  D、用NaOH标准溶液滴定锥形瓶中的盐酸
D、用NaOH标准溶液滴定锥形瓶中的盐酸  10. 下列各组物质中,满足下图物质一步转化关系的选项是( )
10. 下列各组物质中,满足下图物质一步转化关系的选项是( )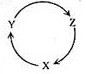
选项
X
Y
Z
A
Na
NaOH
NaHCO3
B
Cu
CuSO4
Cu(OH)2
C
C
CO
CO2
D
Si
SiO2
H2SiO3
A、A B、B C、C D、D11. 常温下,下列溶液的离子浓度关系式正确的是( )A、pH=4的醋酸溶液稀释10倍,溶液中c(CH3COOH)、c(OH-)均减小 B、等物质的量浓度的①H2CO3②NaHCO3③(NH4)2CO3三种溶液的c(CO )的大小关系为③>①>② C、CH3COONa溶液的pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol·L-1 D、0.1mol·L-1的氨水pH=a,0.01mol·L-1的氨水pH=b,则a-l=b12. 下列实验现象或操作正确且与结论相匹配的是( )现象或操作
结论
A
相同条件下,分别测量0.1 mol•L-1和0.01 mol•L-1醋酸溶液的导电性,前者的导电性强
醋酸浓度越大,电离程度越大
B
将H2O2溶液滴加到酸性KMnO4溶液中,溶液褪色
H2O2具有氧化性
C
常温下将大小相同的铝片分别加入到浓硝酸和稀硝酸中,浓硝酸比稀硝酸反应更剧烈
反应物浓度越大,反应速率越快
D
向碘水中加入CCl4振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
A、A B、B C、C D、D13. 某柔性屏手机的柔性电池以碳纳米管做电极材料,以ZnSO4溶液的有机高聚物为固态电解质,其电池总反应为:MnO2+ Zn+(1+ )H2O+ ZnSO4 MnOOH+ ZnSO4·3Zn(OH)2·xH2O,其电池结构如图所示,下列说法正确的是( )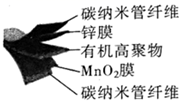 A、放电时,锌膜发生还原反应 B、放电时,电池的正极反应为:MnO2+e-+H+=MnOOH C、充电时,Zn2+移向MnO2膜 D、充电时,含有锌膜的碳纳米管纤维一端连接电源负极14. 向NaOH溶液中缓慢通入CO2气体,溶液中CO 的物质的量与通入CO2物质的量的关系如图。下列关于图中a、b、c三点溶液的说法错误的是( )
A、放电时,锌膜发生还原反应 B、放电时,电池的正极反应为:MnO2+e-+H+=MnOOH C、充电时,Zn2+移向MnO2膜 D、充电时,含有锌膜的碳纳米管纤维一端连接电源负极14. 向NaOH溶液中缓慢通入CO2气体,溶液中CO 的物质的量与通入CO2物质的量的关系如图。下列关于图中a、b、c三点溶液的说法错误的是( )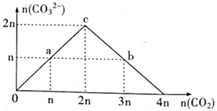 A、a、b、c三点溶液都满足:c(Na+)+c(H+)=c(HCO )+2c(CO )+c(OH-) B、a、b、c三点溶液中水的电离程度:a=b<c C、a、b两点溶液的pH满足:pH(a)>pH(b) D、b点溶液满足:c(Na+)>c(HCO )>c(CO )>c(OH-)>c(H+)
A、a、b、c三点溶液都满足:c(Na+)+c(H+)=c(HCO )+2c(CO )+c(OH-) B、a、b、c三点溶液中水的电离程度:a=b<c C、a、b两点溶液的pH满足:pH(a)>pH(b) D、b点溶液满足:c(Na+)>c(HCO )>c(CO )>c(OH-)>c(H+)二、填空题
-
15. 硫及其化合物在工业生产、生活中有重要的用途。(1)、S、Cl、N三种元素常见的氢化物中,写出属于非电解质的电子式。(2)、已知PbS与O2在高温时生成铅的氧化物和SO2 , 化学平衡常数(K)的表达式为:K= 。写出上述反应的化学方程式。(3)、SO2、Na2S2O3、Na2S、Na2SO3、Na2SO4是五种含硫的化合物。
①上述物质中,涉及元素形成简单离子半径由大到小的顺序是。
②Na2S又称臭碱,用离子方程式说明Na2S溶液呈碱性的原因。
③Na2SO3溶液中各离子浓度由大到小的顺序是。
④棉织物用氯气漂白后,加入Na2S2O3除去余氯时生成SO ,写出该反应的离子方程式。若反应中生成2molSO ,则转移电子 mol。
16. X、Y、L、M、N为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、M与N三种元素的质子数均为5的倍数,Y与L同主族。回答下列问题:(1)、X与M组成的最简单化合物的化学式是。(2)、X与N组成的物质是 (填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式是。(3)、Y在周期表中的位置是 , 其含氧酸的化学式是。(4)、M与N形成的化合物中M的化合价是。(5)、在25℃、101kPa下,已知13.5g的L固体单质在氧气中完全燃烧后恢复到原状态,放热419kJ,该反应的热化学方程式是。17.(1)、科学家经过研究发现中国霾接近中性,其主要原因如图所示: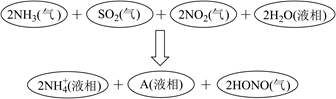
请判断A是 (填化学符号)。
(2)、为探究本地区雾霾中的可溶性颗粒的成分,某化学研究性小组进行了实验探究。[查阅资料]雾霾颗粒样品中可能含有SO 、CO 、SO 、HCO 、NO 、Cl-、Br-及一种常见阳离子,现进行如图实验:
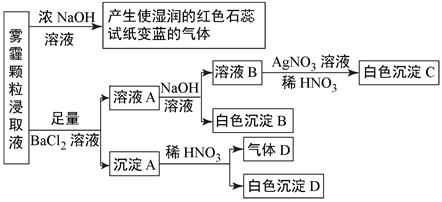
请回答下列问题:
①根据上述实验,雾霾浸取液中一定含有的离子是 , 肯定没有的离子是。
②若气体D遇空气会变成红棕色,则沉淀A中一定含有 (填化学式)。
(3)、当前频繁出现的雾霾天气与汽车尾气的排放有一定的关系。通过NOx传感器可监测NOx的含量,其工作原理示意图如图: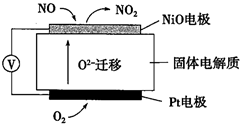
①Pt电极上发生的是反应(填“氧化”或“还原”)。
②写出Pt电极的电极反应式。
③写出NiO电极的电极反应式。
18. 苯乙烯是一种重要的化工原判,可采用乙苯催化脱氢法制备,反应如下: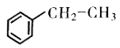 (g)
(g) 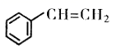 (g)+H2(g) △H(1)、已知
(g)+H2(g) △H(1)、已知化学键
C—H
C—C
C=C
H—H
键能/kJ•mol-1
412
348
612
436
计算上述反应的△H=。
(2)、实际生产中往刚性容器中同时通入乙苯和大量水蒸气,控制反应温度为600℃、体系起始总压强为100kPa的条件下进行反应。测得体系总压和乙苯转化率随时间变化结果如图所示。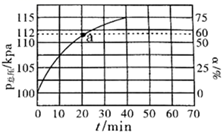
①请用化学平衡理论解释通入大量水蒸气的原因。
②平衡时,p(H2O)= kPa,平衡常数Kp=kPa(Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数)
③反应速率v=v正-v逆=k正·p(乙苯)-k逆·p(苯乙烯)·p(氢气) , k正、k逆分别为正、逆反应速率常数。计算a处的 =。
(3)、苯乙烯与溴化氢发生的加成反应产物有两种,其反应的化学方程式如下:i.C6H5-CH=CH2(g)+HBr(g) C6H5-CH2CH2Br(g)
ii.C6H5-CH=CH2(g)+HBr(g) C6H5-CHBrCH3(g)
600℃时,向3L恒容密闭容器中充入1.2molC6H5-CH=CH2(g)和1.2molHBr(g)发生反应,达到平衡时C6H5-CH2CH2Br(g)和C6H5-CHBrCH3(g)的物质的量(n)随时间(t)变化的曲线如图所示。
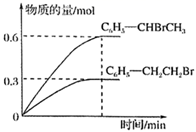
①600℃时,反应ii的化学平衡常数Kii=。
②反应平衡后,若保持其他条件不变,向该容器中再充入1molC6H5-CH2CH2Br(g),则反应ii将 (填“正向”“逆向”或“不”)移动。
③在恒温恒容的密闭容器中,苯乙烯与溴化氢发生i、ii两个加成反应,可以判断反应已达到平衡状态的是 (填编号)。
A.容器内混合气体的密度不再改变
B.C6H5-CH2CH2Br(g)的生成速率与C6H5-CHBrCH3(g)的分解速率相等
C.反应器中压强不再随时间变化而变化
D.混合气体的平均相对分子质量保持不变
19. 以菱锰矿(主耍成分MnCO3 , 还含有FeCO3、CaCO3、SiO2、Al2O3 , Fe2O3、MgCO3等杂质)为原料制备二氧化锰的工艺流程如图: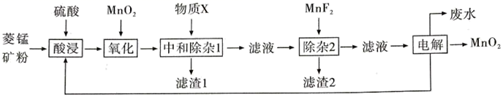
已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10、Ksp(MnF2)=5.0×10-3
(1)、写出“氧化”时发生反应的离子方程式。(2)、“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用 (填编号)。A、Cu B、CuCO3 C、NaOH D、MnCO3(3)、“除杂2”除去的主要离子是 (填离子符号)。(4)、除MnO2外该流程中可以循环使用的物质是。(5)、工业上采用如图所示的方法获得MnO2 , Mn2+将在极(填“C”或“D”)发生反应生成MnO2 , 电极反应式为。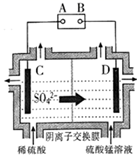 (6)、电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=。[已知:H2S的电离常数K1=1.0×10-7 , K2=7.0×10-15;Ksp(MnS)=1.4×10-15]20. 高铁酸钾( )是一种新型、高效、多功能水处理剂,且不会造成二次污染。
(6)、电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=。[已知:H2S的电离常数K1=1.0×10-7 , K2=7.0×10-15;Ksp(MnS)=1.4×10-15]20. 高铁酸钾( )是一种新型、高效、多功能水处理剂,且不会造成二次污染。查阅资料:
① 为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
② 与 溶液在20℃以下反应生成 ,在较高温度下则生成 。
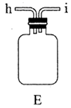
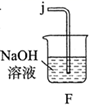
(1)、实验室常利用氯气制备 后与 、 反应制备 。根据下列仪器,请你组装合理、简洁的实验装置,所用装置的接口连接顺序是。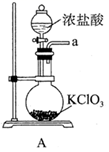
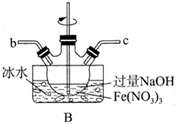
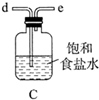
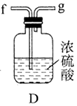
 (2)、写出装置A中发生反应的离子方程式。(3)、三颈烧瓶用冰水浴的原因是 , A处盛放 的仪器名称是。(4)、将实验得到的 再加入饱和 溶液中,可析出紫黑色的 粗晶体,其原因是。(5)、用滴定法测定所制粗 的纯度(杂质与 不反应):取 粗 样品,加入足量硫酸酸化的 溶液,充分反应后,用 标准溶液滴定生成的I2 , 滴定消耗标准溶液的体积为 。涉及的反应有: , 。
(2)、写出装置A中发生反应的离子方程式。(3)、三颈烧瓶用冰水浴的原因是 , A处盛放 的仪器名称是。(4)、将实验得到的 再加入饱和 溶液中,可析出紫黑色的 粗晶体,其原因是。(5)、用滴定法测定所制粗 的纯度(杂质与 不反应):取 粗 样品,加入足量硫酸酸化的 溶液,充分反应后,用 标准溶液滴定生成的I2 , 滴定消耗标准溶液的体积为 。涉及的反应有: , 。①滴定时选用的指示剂是 , 滴定终点的现象是。
②制得粗 的纯度是。