山东省临沂市2021年高考化学一模试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关。下列说法错误的是( )A、非处方药的包装上印有“OTC”标示 B、减少使用氟氯代烷作制冷剂,能保护臭氧层 C、在酒化酶的作用下葡萄糖水解为乙醇和二氧化碳 D、维生素 C具有还原性,在人体内起抗氧化作用2. 实验室中下列做法正确的是( )A、用氨水鉴别 AlCl3溶液与 AgNO3溶液 B、用带有橡胶塞的棕色玻璃瓶保存浓硝酸 C、用湿润的 pH 试纸测定 CH3COONa 溶液的 pH D、用稀硫酸清洗做焰色反应的铂丝3. NA为阿伏加德罗常数的值。下列说法正确的是( )A、12 g NaHSO4晶体中阴离子所带电荷数为 0.2NA B、标准状况下,2.24 L CH3Cl中含有共价键的数目为0.4NA C、1L pH=13 的 Ba(OH)2溶液中 Ba2+数目为 0.1NA D、0.1mol FeI2与 0.1 mol Cl2 反应时转移电子的数目为0.3NA4. 三草酸合铁酸钾( )是制备铁触媒的主要原料。该配合物在光照下发生分解: 。下列说法错误的是( )A、Fe3+的最高能层电子排布式为 3d5 B、 中铁离子的配位数为 6 C、 中 C原子的杂化方式为 sp2 D、CO2 分子中σ键和π键数目比为1:15. 利用下列装置进行实验,能达到实验目的的是( )
A
B
C
D
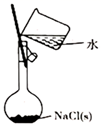

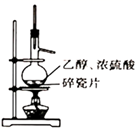
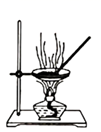
配制0.10mol·L-1 NaCl(aq)
收集SO2并吸收尾气
制取C2H4
蒸干MnCl2溶液制
A、A B、B C、C D、D6. 如图所示化合物是一种常见的储氢材料,其中 X、Y、Z为原子序数依次增大的短周期主族元素,且 X、Y、Z 处于不同周期。下列叙述错误的是( )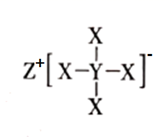 A、第一电离能:X>Y B、原子半径:Z>Y C、Y的最高价氧化物的水化物是一元强酸 D、Z与 X可形成离子化合物 ZX7. 化合物 M是某药物的中间体,结构简式如图所示。下列说法错误的是( )
A、第一电离能:X>Y B、原子半径:Z>Y C、Y的最高价氧化物的水化物是一元强酸 D、Z与 X可形成离子化合物 ZX7. 化合物 M是某药物的中间体,结构简式如图所示。下列说法错误的是( )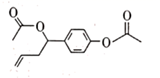 A、M的分子式为 B、M 中含有1个手性碳原子 C、M 在酸性条件下的水解产物有三种 D、1 mol M 最多与3 mol NaOH 发生反应8. 溴乙烷是有机合成的重要原料,实验室中可由乙醇与氢溴酸反应制备,路线如下。
A、M的分子式为 B、M 中含有1个手性碳原子 C、M 在酸性条件下的水解产物有三种 D、1 mol M 最多与3 mol NaOH 发生反应8. 溴乙烷是有机合成的重要原料,实验室中可由乙醇与氢溴酸反应制备,路线如下。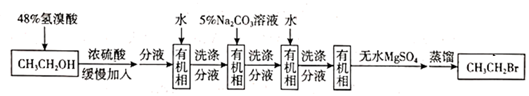
下列说法错误的是( )
A、萃取振荡时,分液漏 斗,下口应倾斜向上 B、用5% Na2CO3溶液洗涤分液时,有机相在分液漏斗的下层 C、无水 MgSO4的作用是除去有机相中残存的少量水 D、蒸馏除去残余反应物乙醇时,乙醇先蒸馏出体系9. 最近我国科学家以 CO2与辛胺为原料实现了甲酸盐和辛腈的高选择性合成,该装置的工作原理如图所示。下列说法正确的是( )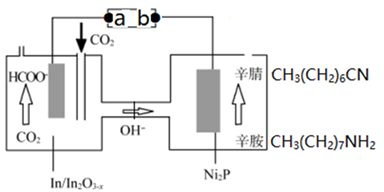 A、b为电源的负极 B、In/ 电极上可能有副产物 O2生成 C、每生成1mol辛腈,同时生成1mol HCOO- D、在 Ni2P 电极上发生的反应为:10. 在 MoO3作用下,HOCH2CH(OH)CH3发生反应的历程如下图所示。下列说法错误的是( )
A、b为电源的负极 B、In/ 电极上可能有副产物 O2生成 C、每生成1mol辛腈,同时生成1mol HCOO- D、在 Ni2P 电极上发生的反应为:10. 在 MoO3作用下,HOCH2CH(OH)CH3发生反应的历程如下图所示。下列说法错误的是( ) A、MoO3改变反应途径,提高了单位时间原料转化率 B、反应过程中 Mo 形成的共价键数目始终保持不变 C、总反应为 D、如果原料为乙二醇,则主要有机产物是甲醛和乙烯11. 下列实验操作、现象和结论均正确的是( )
A、MoO3改变反应途径,提高了单位时间原料转化率 B、反应过程中 Mo 形成的共价键数目始终保持不变 C、总反应为 D、如果原料为乙二醇,则主要有机产物是甲醛和乙烯11. 下列实验操作、现象和结论均正确的是( )实验操作
实验现象
结论
A
将 Cu 与浓硫酸反应后的混合物冷却,再向其中加入蒸馏水
溶液变蓝
有 生成
B
向0.1 molL-1 H2O2溶液中滴加 0.1 mol·L-1 KMnO4溶液
溶液褪色
具有氧化性
C
在 K2Cr2O7溶液中加入 AgNO3溶液
有砖红色沉淀( )生成
D
向淀粉溶液中加入适量 20%的 H2SO4溶液,加热,冷却后加入足量 NaOH溶液,再滴加少量碘水
溶液未变蓝色
淀粉已完全水解
A、A B、B C、C D、D12. 氧化锌是一种常用的化学添加剂,以钢铁厂烟灰(主要成分为 ZnO,并含少量的 CuO、MnO2、Fe2O3等)为原料制备氧化锌的工艺流程如下。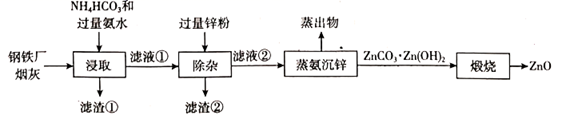
已知:浸取工序中ZnO,CuO分别转化为 和 。下列说法错误的是( )
A、除杂时的离子方程式为 B、浸取和蒸氨沉锌的操作均应在较高温度下进行 C、蒸出物用氨水吸收后可返回浸取工序循环使用 D、滤渣①用 H2SO4溶液处理后得到 溶液和 MnO2 固体二、多选题
-
13. 我国科学家最近发明了一种 Zn-PbO2电池,电解质为K2SO4、H2SO4和KOH,通过 a和 b两种离子交换膜将电解质溶液隔开,形成 M、R、N三个电解质溶液区域,结构示意图如下。下列说法正确的是( )
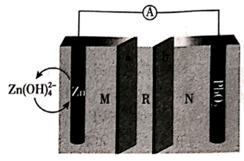 A、b为阳离子交换膜 B、R 区域的电解质为H2SO4 C、放电时,Zn 电极反应为: D、消耗 6.5 g Zn,N 区域电解质溶液减少 16.0 g14. 研究含铅废水的处理具有重要意义。向含 Pb2+的废水中逐滴滴加 NaOH溶液,溶液变浑浊,继续滴加 NaOH 溶液又变澄清。溶液中 Pb2+及其与 OH-形成的微粒的浓度分数(α)随溶液 pH 变化的关系如图所示。下列说法正确的是( )
A、b为阳离子交换膜 B、R 区域的电解质为H2SO4 C、放电时,Zn 电极反应为: D、消耗 6.5 g Zn,N 区域电解质溶液减少 16.0 g14. 研究含铅废水的处理具有重要意义。向含 Pb2+的废水中逐滴滴加 NaOH溶液,溶液变浑浊,继续滴加 NaOH 溶液又变澄清。溶液中 Pb2+及其与 OH-形成的微粒的浓度分数(α)随溶液 pH 变化的关系如图所示。下列说法正确的是( )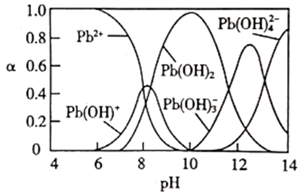 A、Pb2+的浓度分数先减小后增大 B、除去溶液中的 Pb2+ , 应将溶液的pH调至约为10 C、pH=7时,溶液中的阳离子仅有Pb2+和Pb(OH)+ D、pH≥13 时,溶液中发生的主要反应为:15. 丙酮是重要的有机合成原料,可以由过氧化氢异丙苯合成。其反应为:
A、Pb2+的浓度分数先减小后增大 B、除去溶液中的 Pb2+ , 应将溶液的pH调至约为10 C、pH=7时,溶液中的阳离子仅有Pb2+和Pb(OH)+ D、pH≥13 时,溶液中发生的主要反应为:15. 丙酮是重要的有机合成原料,可以由过氧化氢异丙苯合成。其反应为: ,为了提高过氧化氢异丙苯的转化率,反应进行时需及时从溶液体系中移出部分苯酚。过氧化氢异丙苯的转化率随反应时间的变化如图所示。设过氧化氢异丙苯的初始浓度为x mol·L-1 , 反应过程中的液体体积变化忽略不计。下列说法正确的是( )
,为了提高过氧化氢异丙苯的转化率,反应进行时需及时从溶液体系中移出部分苯酚。过氧化氢异丙苯的转化率随反应时间的变化如图所示。设过氧化氢异丙苯的初始浓度为x mol·L-1 , 反应过程中的液体体积变化忽略不计。下列说法正确的是( ) 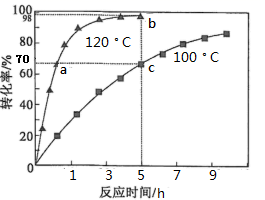 A、a、c 两点丙酮的物质的量浓度相等 B、b、c两点的逆反应速率:v(b)<v(c) C、100 ℃时,0~5 h 之间丙酮的平均反应速率为 0.14x mol·L-1·h-1 D、若b点处于化学平衡,则120℃时反应的平衡常数
A、a、c 两点丙酮的物质的量浓度相等 B、b、c两点的逆反应速率:v(b)<v(c) C、100 ℃时,0~5 h 之间丙酮的平均反应速率为 0.14x mol·L-1·h-1 D、若b点处于化学平衡,则120℃时反应的平衡常数三、非选择题
-
16. 一种从阳极泥(主要成分为 Cu、Ag、Pt、Au、Ag2Se和Cu2S等)中回收 Se和贵重金属的工艺流程如下图所示。
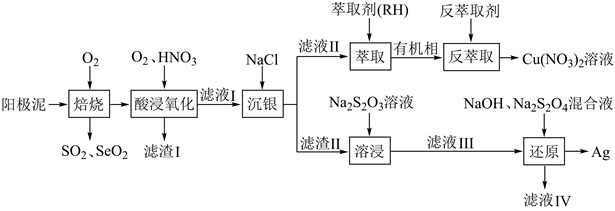
已知:①该工艺中萃取与反萃取原理为: ;
② 易与 Ag+形成配离子: ,常温下该反应的平衡常数 。
回答下列问题:
(1)、“焙烧”产生的SO2与 SeO2的混合烟气可用水吸收制得单质 Se,该反应的化学方程式为。(2)、“滤渣Ⅰ”的主要成分是;“酸浸氧化”中通入氧气的目的是。(3)、“反萃取剂”最好选用(填化学式)溶液。(4)、“溶浸”中发生的反应为 ,该反应的平衡常数K'=。[已知 ](5)、“滤液IV”中含有 Na2SO3 , 则“还原”中发生反应的离子方程式为;“滤液 IV”可返回“溶浸”工序循环使用,但循环多次后,银的浸出率会降低,原因是(试用平衡原理解释)。17. 我国科研工作者最近发现并制备了一系列主要由 O、P、Se、Bi 等元素组成的导电材料。回答下列问题:(1)、基态硒原子的价电子排布式为;SeO2的熔点为 350 ℃,加热易升华,固态SeO2属于 晶体。(2)、O、P、S三种元素中,电负性最大的是;键角:H2OH2Se(填">"、"<"或"=")。(3)、纯净的磷酸粘度极大,随温度升高粘度迅速下降,原因是;熔融状态的磷酸导电性很好,这是由于在纯磷酸中存在如下质子交换导电机理。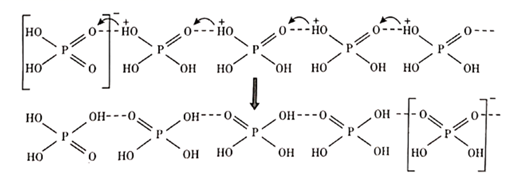
由此可以推知纯磷酸液体中存在的导电微粒是 和 , 的空间构型为。
(4)、硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的 层与带负电的 层交替堆叠。据此推断硒氧化铋的化学式为 , 其中Se的分数坐标为。晶胞棱边夹角均为90°,硒氧化铋的摩尔质量为 M g·mol-1 , 则晶体密度的表达式为g·cm-3(NA为阿伏加德罗常数的值)。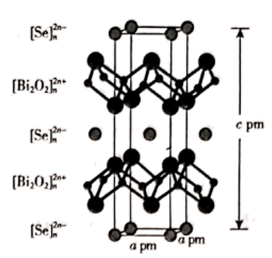 18. 三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室利用反应 制取 CrCl3 , 其实验装置如下图所示。
18. 三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室利用反应 制取 CrCl3 , 其实验装置如下图所示。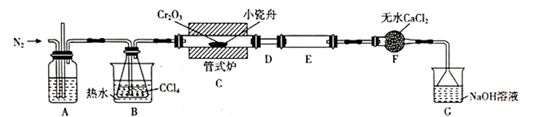
已知:①COCl2(俗称光气)有毒,遇水发生水解: ;
②碱性条件下,H2O2将Cr3+氧化为 ;酸性条件下,H2O2将 还原为Cr3+。
回答下列问题:
(1)、A中的试剂为;无水 CaCl2的作用是;反应结束后继续通入一段时间氮气,主要目的是。(2)、装置 E用来收集产物,实验过程中若 D处出现堵塞,可观察到的现象是 ;可通过(填操作),使实验能继续进行。(3)、装置 G 中发生反应的离子方程式为。(4)、测定产品中 CrCl3质量分数的实验步骤如下:I.取m g CrCl3产品,在强碱性条件下,加入过量的30% H2O2溶液,小火加热使 CrCl3完全转化为 ,继续加热一段时间;
Ⅱ.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使 转化为 ;
Ⅲ.用新配制的 标准溶液滴定至终点,消耗 标准溶液V mL(已知 被 Fe2+ 还原为Cr3+)。
①产品中 CrCl3 质量分数表达式为。
②下列操作将导致产品中 CrCl3质量分数测定值偏低的是(填标号)。
a.步骤Ⅰ中未继续加热一段时间
b.步骤Ⅱ中未加浓磷酸
c.步骤Ⅲ中所用 溶液已变质
d.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
四、原理综合题
-
19. 二甲醚(CH3OCH3)被称为“21世纪的清洁燃料”。以 CO2、H2为原料制备二甲醚涉及的主要反应如下:
I.
Ⅱ.
回答下列问题:
(1)、反应 的△H=。(2)、在压强、CO2和H2的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得 CO2平衡转化率和平衡时 CH3OCH3的选择性随温度的变化如图所示。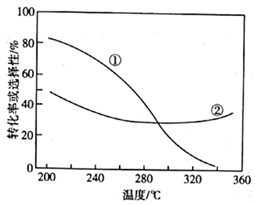
已知: 的选择性= ×100%。其中表示平衡时 的选择性的是曲线(填"①"或"②");温度高于 300℃时,曲线②随温度升高而升高的原因是;为同时提高 CO2的平衡转化率和平衡时 的选择性,应选择的反应条件为(填标号)。
a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
(3)、也可以利用甲醇脱水制备二甲醚: 。已知: ,其中 Kp为以分压表示的平衡常数,T 为热力学温度。①为提高 CH3OCH3的平衡产率,可以采取的措施有(任写一条)。
②473 K时,在密闭容器中加入一定量 CH3OH(g),采用合适的催化剂进行反应,达到平衡时体系中 CH3OCH3(g)的物质的量分数为(填标号)。
a.< b. c. ~ d. >
(4)、对于反应 ,反应速率v=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。①降低温度,k正-k逆(填"增大"、"减小"或"不变");
②在TK、101kPa下,按照 投料,CO2转化率为50%时, ,用气体分压表示的平衡常数 Kp=。
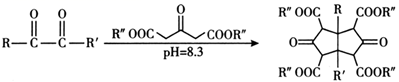
20. 化合物F是一种医药化工合成中间体,其合成路线如下图。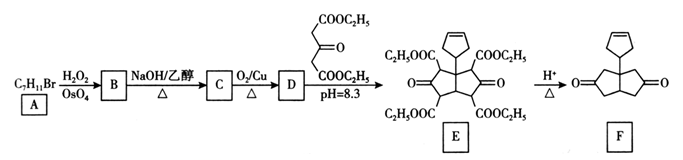
已知:①R—CH=CH2

②
 (1)、A的结构简式为;B→C的反应类型为;E中含氧官能团的名称为。(2)、C→D的反应方程式为。(3)、符合下列条件的D的同分异构体共有种(不考虑立体异构)。
(1)、A的结构简式为;B→C的反应类型为;E中含氧官能团的名称为。(2)、C→D的反应方程式为。(3)、符合下列条件的D的同分异构体共有种(不考虑立体异构)。①遇FeCl3溶液显紫色;②1mol该物质能与足量Na反应生成1mo1H2。
其中核磁共振氢谱有四组峰,峰面积之比为3:2:2:1的结构简式为(任写一种)。
(4)、设计由1,2—二氯乙烷与 制备
制备  的合成路线(其他试剂任选)。
的合成路线(其他试剂任选)。