江苏省宿迁市2021年高考化学二模试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 食品安全重于泰山。下列做法不当的是( )A、向葡萄酒中添加少量SO2 B、向海鲜中加入少量甲醛 C、面粉发酵时加入少量小苏打 D、向水果罐头中加入维生素C2. 反应CO2 + 2NaOH = Na2CO3 + H2O可用于捕捉废气中的CO2 , 下列表示或说法正确的是( )A、NaOH的电子式:
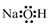 B、中子数为8的碳原子:
C、CO 的空间构型:平面三角形
D、CO 的水解方程式:CO +2H2O H2CO3+2OH−
3. 下列有关物质的性质与用途具有对应关系的是( )A、NH4HCO3受热易分解,可用作氮肥 B、氧化铝硬度很大,可用于制造耐火材料 C、Na2O2固体呈淡黄色,可用作潜水艇中的供氧剂 D、ClO2具有强氧化性,可用于自来水的杀菌消毒4. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、0.1mol·L−1 Fe2(SO4)3溶液:Na+、K+、I−、CO B、0.1mol·L−1 KCl溶液:Cu2+、NH 、NO 、SO C、0.1mol·L−1 H2SO4溶液:Mg2+、K+、F−、NO D、0.1mol·L−1 Ba(OH)2溶液:Cu2+、Na+、SO 、HCO5. 以含钴废渣(主要成分CoO、Co2O3 , 还含有Al2O3、ZnO等杂质)为原料制备Co2O3的一种实验流程如下:
B、中子数为8的碳原子:
C、CO 的空间构型:平面三角形
D、CO 的水解方程式:CO +2H2O H2CO3+2OH−
3. 下列有关物质的性质与用途具有对应关系的是( )A、NH4HCO3受热易分解,可用作氮肥 B、氧化铝硬度很大,可用于制造耐火材料 C、Na2O2固体呈淡黄色,可用作潜水艇中的供氧剂 D、ClO2具有强氧化性,可用于自来水的杀菌消毒4. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、0.1mol·L−1 Fe2(SO4)3溶液:Na+、K+、I−、CO B、0.1mol·L−1 KCl溶液:Cu2+、NH 、NO 、SO C、0.1mol·L−1 H2SO4溶液:Mg2+、K+、F−、NO D、0.1mol·L−1 Ba(OH)2溶液:Cu2+、Na+、SO 、HCO5. 以含钴废渣(主要成分CoO、Co2O3 , 还含有Al2O3、ZnO等杂质)为原料制备Co2O3的一种实验流程如下:
下列与流程相关的装置和原理能达到实验目的的是( )
 A、用装置甲制备“酸浸”所需的SO2 B、用装置乙配制“酸浸”所需的1mol·L-1H2SO4溶液 C、用装置丙过滤“沉钴”所得悬浊液 D、用装置丁灼烧CoCO3固体制Co2O36. 为探究新制氯水的性质,某学生做了如下实验。其中涉及离子反应方程式书写正确的是( )
A、用装置甲制备“酸浸”所需的SO2 B、用装置乙配制“酸浸”所需的1mol·L-1H2SO4溶液 C、用装置丙过滤“沉钴”所得悬浊液 D、用装置丁灼烧CoCO3固体制Co2O36. 为探究新制氯水的性质,某学生做了如下实验。其中涉及离子反应方程式书写正确的是( )实验
装置
试剂X
现象
①

滴有酚酞的NaOH溶液
溶液红色褪色
②
NaHCO3溶液
产生气泡
③
HNO3酸化的AgNO3溶液
产生白色沉淀
④
FeCl2溶液、KSCN溶液
溶液变红
A、实验①:Cl2+2NaOH=Cl-+ClO-+2Na++H2O B、实验②: +HClO=ClO-+CO2↑+H2O C、实验③:ClO-+Ag++H2O=AgCl↓+2OH- D、实验④:Cl2+2Fe2+=2Fe3++2Cl-7. 在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案(原理如图),下列说法错误的是( ) A、电源a端为负极 B、Fe2+的电子排布式为[Ar]3d6 C、阳极发生的电极反应式为2HCl-2e-=2H++Cl2 D、电路中转移1mol电子,需要消耗11.2LO2(标准状况)8. 叶腊石 是一种黏土矿物,广泛应用于陶瓷、冶金、建材等领域。 、 、 、 均为短周期元素,原子序数依次递增。 是地壳中含量最高的元素, 原子在元素周期表中的周期数等于族序数, 的简单阳离子与 含有相同的电子数, 原子最高能级和最低能级填充电子的数目相等,下列说法正确的是( )A、叶腊石中只含有离子键 B、第一电离能大小: C、工业上常用电解法制备元素 的单质 D、 的最高价氧化物的水化物可溶于 的最高价氧化物的水化物9. 在给定的条件下,下列选项所示的物质间转化均能实现的是( )A、N2(g) NO(g) HNO3(aq) B、Al2O3(s) Al(s) NaAlO2(aq) C、BaCl2(aq) BaCO3(s) BaSO4(s) D、MgCl2·6H2O(s) MgCl2(s) Mg(s)10. Cu-ZnO-ZrO2可催化CO2加氢制备甲醇,反应过程如图所示(其中吸附在催化剂表面的物种用*标注)。下列说法错误的是( )
A、电源a端为负极 B、Fe2+的电子排布式为[Ar]3d6 C、阳极发生的电极反应式为2HCl-2e-=2H++Cl2 D、电路中转移1mol电子,需要消耗11.2LO2(标准状况)8. 叶腊石 是一种黏土矿物,广泛应用于陶瓷、冶金、建材等领域。 、 、 、 均为短周期元素,原子序数依次递增。 是地壳中含量最高的元素, 原子在元素周期表中的周期数等于族序数, 的简单阳离子与 含有相同的电子数, 原子最高能级和最低能级填充电子的数目相等,下列说法正确的是( )A、叶腊石中只含有离子键 B、第一电离能大小: C、工业上常用电解法制备元素 的单质 D、 的最高价氧化物的水化物可溶于 的最高价氧化物的水化物9. 在给定的条件下,下列选项所示的物质间转化均能实现的是( )A、N2(g) NO(g) HNO3(aq) B、Al2O3(s) Al(s) NaAlO2(aq) C、BaCl2(aq) BaCO3(s) BaSO4(s) D、MgCl2·6H2O(s) MgCl2(s) Mg(s)10. Cu-ZnO-ZrO2可催化CO2加氢制备甲醇,反应过程如图所示(其中吸附在催化剂表面的物种用*标注)。下列说法错误的是( ) A、H2O参与了该催化循环 B、存在反应*H3CO-+H2O=CH3OH+*HO- C、CO2与CH3OH分子中碳原子的轨道杂化类型分别为sp2和sp3 D、该催化循环中生成了有毒气体CO11. 合成氨是人类科学技术发展史上的一项重大突破。其反应为:N2 (g)+3H2(g) 2NH3(g),该反应一定条件下自发。下列有关说法正确的是( )A、NH3分子是由极性键构成的非极性分子 B、该反应的ΔH<0,ΔS<0 C、用E表示键能,该反应的ΔH=6E(N-H)-E(N≡N)-3E(H-H) D、将生产的氨气分离出去,可以增大正反应速率同时提高反应物转化率12. 室温下,进行下列实验,根据实验操作和现象所得的结论正确的是( )
A、H2O参与了该催化循环 B、存在反应*H3CO-+H2O=CH3OH+*HO- C、CO2与CH3OH分子中碳原子的轨道杂化类型分别为sp2和sp3 D、该催化循环中生成了有毒气体CO11. 合成氨是人类科学技术发展史上的一项重大突破。其反应为:N2 (g)+3H2(g) 2NH3(g),该反应一定条件下自发。下列有关说法正确的是( )A、NH3分子是由极性键构成的非极性分子 B、该反应的ΔH<0,ΔS<0 C、用E表示键能,该反应的ΔH=6E(N-H)-E(N≡N)-3E(H-H) D、将生产的氨气分离出去,可以增大正反应速率同时提高反应物转化率12. 室温下,进行下列实验,根据实验操作和现象所得的结论正确的是( )选项
实验操作和现象
结论
A
向NaOH固体中加入少量稀盐酸,测得溶液温度高于室温
盐酸与氢氧化钠的反应为放热反应
B
向Na2SO3溶液中,加入BaCl2溶液,产生白色沉淀,过滤洗涤后,向所得沉淀中加入足量稀硝酸,沉淀不溶解
原Na2SO3溶液已变质
C
向pH=3的醋酸溶液中,加入醋酸铵溶液,溶液pH增大
醋酸铵溶液呈碱性
D
向含有少量CuCl2的MgCl2溶液中,滴加几滴氨水,产生蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
A、A B、B C、C D、D二、多选题
-
13. Calebin A可用于治疗阿尔茨海默病,在其合成过程中有如下物质转化过程:

下列有关化合物X、Y和Z的说法正确的是( )
A、苯甲醛与X互为同系物 B、X、Y和Z的分子中,均只含有1个手性碳原子 C、可用新制Cu(OH)2悬浊液检验Z中是否混有X D、1mol Z最多可与4molH2发生加成反应14. 常温下,以酚酞作指示剂,用0.1 mol/L的NaOH溶液滴定20.00 mL 0.1 mol/L的二元酸H2A溶液。溶液中pH、分布系数δ随滴加NaOH溶液体积V(NaOH)的变化关系如图所示。[A2−的分布系数为 ]( )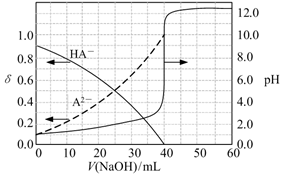 A、当V(NaOH)=0 mL时,c(HA-)+c(A2-)=0.1 mol/L B、当V(NaOH)=20.00 mL时,c(Na+)>c(HA-)+2c(A2-) C、常温下,A2-的水解常数值为1.0×10-12 D、当V(NaOH)=30.00 mL时,c(HA-)+c(H+)=c(A2-)+c(OH-)15. 在恒容密闭容器中发生反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。下列有关说法正确的是( )
A、当V(NaOH)=0 mL时,c(HA-)+c(A2-)=0.1 mol/L B、当V(NaOH)=20.00 mL时,c(Na+)>c(HA-)+2c(A2-) C、常温下,A2-的水解常数值为1.0×10-12 D、当V(NaOH)=30.00 mL时,c(HA-)+c(H+)=c(A2-)+c(OH-)15. 在恒容密闭容器中发生反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。下列有关说法正确的是( )体积
投料
200℃时
HCl平衡转化率
400℃时
HCl平衡转化率
容器I
1L
4mol HCl(g)、1mol O2(g)
90%
75%
容器II
2L
Xmol HCl(g)、2mol O2(g)
α1
α2
A、该反应的ΔH>0 B、400℃时,该反应的平衡常数的值为 C、400℃时,若X >8,则α2 >75% D、400℃时,向容器I平衡体系中再加入1molO2(g)和1molCl2(g),此时v (正)> v (逆)三、非选择题
-
16. 是一种重要的无机化工原料,可用于制备多晶材料、光学玻璃。现有如下两种途径可以制得。(1)、途径Ⅰ 以工业级 溶液(含 和 等杂质)为原料制备 ,过程如下:
工业级 溶液




除杂。①向硫酸镁溶液中加入 ,加热、保持溶液温度在 ,将 转化为 沉淀,反应后滤液的 (填“增大”、“不变”或“减小”);
②调节滤液的 ,使溶液呈弱碱性,向其中加入 ,将 转化为 沉淀,写出该反应的离子方程式。
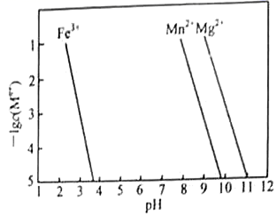
③ ( 、 、 )转变为氢氧化物沉淀的 如图。除杂时未采取将 直接转化为 的原因是。
 (2)、沉镁。向“除杂”后滤液中加入 ,同时产生气体,写出生成 的化学方程式。(3)、酸溶。将所得 置于(填“玻璃”、“聚丙烯”或“石英”)烧杯中,加入适量的 ,搅拌溶解。
(2)、沉镁。向“除杂”后滤液中加入 ,同时产生气体,写出生成 的化学方程式。(3)、酸溶。将所得 置于(填“玻璃”、“聚丙烯”或“石英”)烧杯中,加入适量的 ,搅拌溶解。途径Ⅱ 以磷肥副产物 溶解 ,充分反应后过滤、得 溶液,浓缩得 , 条件下煅烧得 。
(4)、溶解时, 质量分数控制在 的原因:( 时, 的溶解度 )。17. 草酸亚铁晶体(FeC2O4·2H2O)是一种重要的化工原料,广泛应用于涂料、染料、玻璃器皿等的着色剂,也可用于新型电池材料,感光材料的生成。实验室制备草酸亚铁晶体的一种流程如下: (1)、溶解时加入稀硫酸的作用是。(2)、用无水乙醇洗涤的目的是。(3)、某FeC2O4·2H2O样品中含有少量Fe2(C2O4)3杂质,采用KMnO4滴定法测定样品的组成,实验步骤如下:称取1.996 g样品于锥形瓶中,加入稀硫酸溶解,水浴加热至75℃;用0.200 mol/L的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色;消耗KMnO4溶液33.00 mL。
(1)、溶解时加入稀硫酸的作用是。(2)、用无水乙醇洗涤的目的是。(3)、某FeC2O4·2H2O样品中含有少量Fe2(C2O4)3杂质,采用KMnO4滴定法测定样品的组成,实验步骤如下:称取1.996 g样品于锥形瓶中,加入稀硫酸溶解,水浴加热至75℃;用0.200 mol/L的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色;消耗KMnO4溶液33.00 mL。已知:酸性环境下,KMnO4既能氧化Fe2+ , 又能氧化C2O ,自身被还原为Mn2+。
①计算样品中FeC2O4·2H2O的质量分数。 (写出计算过程)
②若滴定过程中,酸度控制不当,MnO 部分会被还原为MnO2 , 则达到滴定终点时,消耗KMnO4溶液的体积(填“偏大”、“偏小”或“不影响”)。
18. 实验室以天青石精矿(主要含SrSO4 , 还含有少量SiO2、CaSO4、BaSO4)为原料制取SrSO4 , 其实验流程如下: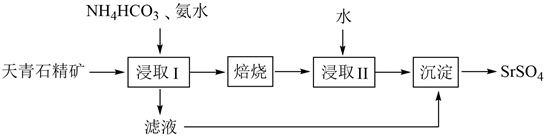 (1)、室温下,反应SrSO4(s)+CO (aq) SrCO3(s)+SO (aq)达到平衡,则反应的平衡常数为[Ksp(SrSO4)=3.2×10−7 , Ksp(SrCO3)=5.6×10−10]。(2)、浸取天青石精矿时,向NH4HCO3溶液中加入适量浓氨水的目的是。“浸取Ⅰ”的条件是温度在60~70℃、搅拌、反应3小时,温度过高将会导致SrSO4的转化率下降,其原因是。(3)、“焙烧”所得SrO粗品用蒸馏水多次浸取得Sr(OH)2溶液。判断SrO粗品已经浸取完全的方法:。(4)、“沉淀”过程中除得到SrSO4外,还得到一种可循环利用的物质,该物质为。(5)、将SrSO4与煤粉按照一定比例混合后煅烧得到一种黑灰(SrS)。
(1)、室温下,反应SrSO4(s)+CO (aq) SrCO3(s)+SO (aq)达到平衡,则反应的平衡常数为[Ksp(SrSO4)=3.2×10−7 , Ksp(SrCO3)=5.6×10−10]。(2)、浸取天青石精矿时,向NH4HCO3溶液中加入适量浓氨水的目的是。“浸取Ⅰ”的条件是温度在60~70℃、搅拌、反应3小时,温度过高将会导致SrSO4的转化率下降,其原因是。(3)、“焙烧”所得SrO粗品用蒸馏水多次浸取得Sr(OH)2溶液。判断SrO粗品已经浸取完全的方法:。(4)、“沉淀”过程中除得到SrSO4外,还得到一种可循环利用的物质,该物质为。(5)、将SrSO4与煤粉按照一定比例混合后煅烧得到一种黑灰(SrS)。①写出生成SrS的化学反应方程式:。
②设计以黑灰为原料,制取SrSO4的实验方案:。
(已知:SrS易溶于水,易水解。水浸时的浸取率随温度变化如下图。实验中锶元素需充分转化SrSO4 , 必须使用的试剂:蒸馏水、3mol·L-1H2SO4和NaOH溶液)。
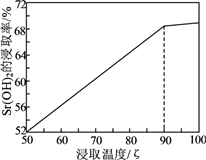 19. 氯化两面针碱具有抗炎、抗真菌、抗氧化和抗HIV等多种生物活性。其合成路线如下:
19. 氯化两面针碱具有抗炎、抗真菌、抗氧化和抗HIV等多种生物活性。其合成路线如下: (1)、C中所含官能团有氰基、和(填名称)。(2)、试剂X的分子式为C9H8O3 , 写出X的结构简式:。(3)、D→E的反应类型为。(4)、A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、C中所含官能团有氰基、和(填名称)。(2)、试剂X的分子式为C9H8O3 , 写出X的结构简式:。(3)、D→E的反应类型为。(4)、A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①能与FeCl3溶液发生显色反应,但不能发生银镜反应;
②碱性水解后酸化,所得两种有机产物分子的核磁共振氢谱图中峰个数分别为2和3。
(5)、写出以 为原料制备
为原料制备  的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 20. 乙烯是世界上产量最大的化学品之一,是石油化工产业的核心。其制备方法在不断的优化,以乙烷为原料制备乙烯,成本较低。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 20. 乙烯是世界上产量最大的化学品之一,是石油化工产业的核心。其制备方法在不断的优化,以乙烷为原料制备乙烯,成本较低。 (1)、传统制备方法:乙烷催化裂解法发生的反应为:C2H6(g) C2H4(g)+H2(g) ΔH
(1)、传统制备方法:乙烷催化裂解法发生的反应为:C2H6(g) C2H4(g)+H2(g) ΔH①已知:298K时,相关物质的相对能量如图:则ΔH=。
②850℃,恒压条件下,常需要通入大量水蒸气,目的是。
(2)、乙烷氧化裂解制乙烯[主反应为C2H6(g)+1/2O2(g) C2H4(g)+H2O (g)]①“乙烷催化裂解法”制备乙烯时,常会发生积碳反应:C2H6(g) 2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是。
②探究该反应的适宜条件,得到下图数据:

已知:C2H4的选择性:指转化的C2H6中生成C2H4的百分比;乙烯的收率=C2H6的转化率×C2H4的选择性。
图甲:表示其它条件相同,不同温度条件下,组成相同的原料气,反应相同的时间,测得的C2H6的转化率、C2H4的选择性以及乙烯的收率与温度的关系;
图乙:表示其他条件相同,C2H6的转化率、C2H4的选择性以及乙烯的收率随原料气中 的变化情况。
用该方法制备乙烯应该选择的适宜条件为:温度; =。
(3)、某乙烯熔融燃料电池工作原理如下图所示:则负极的电极反应式为。