江苏省南京市盐城市2021年高考化学一模试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 大国重器彰显中国实力,化学材料助力科技成果转化运用。下列说法正确的是( )A、“蛟龙号”载人潜水器使用的钛合金是金属材料 B、“C919”大飞机使用的氮化硅陶瓷是传统硅酸盐材料 C、“玉兔二号”月球车使用的太阳能电池板材料是二氧化硅 D、“山东舰”航母使用的碳纤维是一种新型有机高分子材料2. 侯氏制碱法主要反应原理:NH3+NaCl+CO2+H2O=NaHCO3↓+NH4Cl。下列有关说法错误的是( )A、CO2空间构型为直线形 B、NaCl固体为离子晶体 C、Na的原子结构示意图为
 D、NH4Cl的电子式为
D、NH4Cl的电子式为  3. 下列有关物质的性质与用途具有对应关系的是( )A、氢氟酸显弱酸性,可用于雕刻玻璃 B、Na2CO3溶液呈碱性,可用于去除油污 C、Al2O3熔点高,可用作电解冶炼铝的原料 D、S2-具有还原性,可用于去除水体中Pb2+等重金属离子4. 下列有关二氧化硫的说法正确的是( )A、SO2属于电解质 B、SO2为非极性分子 C、SO2既有氧化性又有还原性 D、SO2易溶于水是因为与水能形成分子间氢键5. 实验室制取SO2时,下列装置不能达到相应实验目的的是( )
3. 下列有关物质的性质与用途具有对应关系的是( )A、氢氟酸显弱酸性,可用于雕刻玻璃 B、Na2CO3溶液呈碱性,可用于去除油污 C、Al2O3熔点高,可用作电解冶炼铝的原料 D、S2-具有还原性,可用于去除水体中Pb2+等重金属离子4. 下列有关二氧化硫的说法正确的是( )A、SO2属于电解质 B、SO2为非极性分子 C、SO2既有氧化性又有还原性 D、SO2易溶于水是因为与水能形成分子间氢键5. 实验室制取SO2时,下列装置不能达到相应实验目的的是( ) A、图1:生成SO2 B、图2:检验SO2 C、图3:干燥SO2 D、图4:收集SO26. 蓝天保卫战—持续三年的大气治理之战,其中低成本、高效率处理SO2、NO2等大气污染物一直是化学研究的重点课题,研究它们的性质、制备在工业生产和环境保护中有着重要意义。一种处理SO2、NO2的研究成果,其反应原理为( )SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH1=-41.8kJ·mol-1 , 标准状况下,SO2(g)+NO2(g)=SO3(s)+NO(g) ΔH2.下列有关说法错误的是A、该反应的ΔS>0 B、ΔH2<-41.8kJ·mol-1 C、SO2的生成速率和NO2的消耗速率相等说明该反应达到平衡状态 D、标准状况下,该反应中每生成22.4L NO转移电子的数目约等于2×6.02×10237. 如图为元素周期表中短周期的一部分,下列说法错误的是( )
A、图1:生成SO2 B、图2:检验SO2 C、图3:干燥SO2 D、图4:收集SO26. 蓝天保卫战—持续三年的大气治理之战,其中低成本、高效率处理SO2、NO2等大气污染物一直是化学研究的重点课题,研究它们的性质、制备在工业生产和环境保护中有着重要意义。一种处理SO2、NO2的研究成果,其反应原理为( )SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH1=-41.8kJ·mol-1 , 标准状况下,SO2(g)+NO2(g)=SO3(s)+NO(g) ΔH2.下列有关说法错误的是A、该反应的ΔS>0 B、ΔH2<-41.8kJ·mol-1 C、SO2的生成速率和NO2的消耗速率相等说明该反应达到平衡状态 D、标准状况下,该反应中每生成22.4L NO转移电子的数目约等于2×6.02×10237. 如图为元素周期表中短周期的一部分,下列说法错误的是( )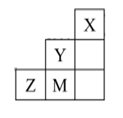 A、离子半径:M->Z2->Y- B、电负性:Y>M>Z C、简单气态氢化物的稳定性:Y>M>Z D、Y元素基态原子的简化电子排布式:[X]2s22p58. 用久置于空气中的生石灰[主要成分为CaO,还含有Ca(OH)2和CaCO3]制取KClO3的流程如下。下列有关说法错误的是( )
A、离子半径:M->Z2->Y- B、电负性:Y>M>Z C、简单气态氢化物的稳定性:Y>M>Z D、Y元素基态原子的简化电子排布式:[X]2s22p58. 用久置于空气中的生石灰[主要成分为CaO,还含有Ca(OH)2和CaCO3]制取KClO3的流程如下。下列有关说法错误的是( ) A、“打浆”的目的是为了提高“氯化”时的反应速率 B、“氯化”中主要发生的化学反应为6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O C、“过滤”后滤液中存在的阳离子有Ca2+、H+ D、“转化”时发生的化学反应属于氧化还原反应9. 对固体电解质体系的研究是电化学研究的重要领域之一、用离子交换膜H+/ 型 Nafion膜作电解质,在一定条件下实现了常温常压下电化学合成氨,原理如下图所示。下列说法错误的是( )
A、“打浆”的目的是为了提高“氯化”时的反应速率 B、“氯化”中主要发生的化学反应为6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O C、“过滤”后滤液中存在的阳离子有Ca2+、H+ D、“转化”时发生的化学反应属于氧化还原反应9. 对固体电解质体系的研究是电化学研究的重要领域之一、用离子交换膜H+/ 型 Nafion膜作电解质,在一定条件下实现了常温常压下电化学合成氨,原理如下图所示。下列说法错误的是( ) A、电极M接电源的正极 B、离子交换膜中H+、 浓度均保持不变 C、H+/ 型离子交换膜具有较高的传导质子能力 D、阴极的电极反应式:N2+6e-+6H+=2NH3 , 2H++2e-=H2↑10. 乙醛与新制氢氧化铜悬浊液反应的实验如下:
A、电极M接电源的正极 B、离子交换膜中H+、 浓度均保持不变 C、H+/ 型离子交换膜具有较高的传导质子能力 D、阴极的电极反应式:N2+6e-+6H+=2NH3 , 2H++2e-=H2↑10. 乙醛与新制氢氧化铜悬浊液反应的实验如下:步骤1:向试管中加入2mL10%NaOH溶液,边振荡边滴加4~6滴2%CuSO4溶液,观察到有蓝色絮状沉淀产生。
步骤2:再向试管中加入0.5mL乙醛溶液,加热,观察到有红色沉淀产生。
下列说法错误的是( )
 A、步骤1中必须加入过量的NaOH溶液 B、步骤2中观察到的红色沉淀为Cu2O C、上述实验说明乙醛能被新制氢氧化铜氧化 D、上图所示Cu2O的晶胞中
A、步骤1中必须加入过量的NaOH溶液 B、步骤2中观察到的红色沉淀为Cu2O C、上述实验说明乙醛能被新制氢氧化铜氧化 D、上图所示Cu2O的晶胞中 表示氧原子
11. 羟甲香豆素(丙)是一种治疗胆结石的药物,部分合成路线如下图所示。下列说法错误的是( )
表示氧原子
11. 羟甲香豆素(丙)是一种治疗胆结石的药物,部分合成路线如下图所示。下列说法错误的是( ) A、甲分子中的含氧官能团为羟基、酯基 B、常温下1mol乙最多与含4molNaOH的水溶液完全反应 C、丙能使酸性高锰酸钾溶液褪色 D、丙分子中碳原子轨道杂化类型为sp2和sp3 , 且所有的碳原子可能共平面12. 室温下,通过下列实验探究FeCl3水解反应[FeCl3(黄色)+3H2O⇌Fe(OH)3(红褐色)+3HCl]的条件。
A、甲分子中的含氧官能团为羟基、酯基 B、常温下1mol乙最多与含4molNaOH的水溶液完全反应 C、丙能使酸性高锰酸钾溶液褪色 D、丙分子中碳原子轨道杂化类型为sp2和sp3 , 且所有的碳原子可能共平面12. 室温下,通过下列实验探究FeCl3水解反应[FeCl3(黄色)+3H2O⇌Fe(OH)3(红褐色)+3HCl]的条件。实验序号
实验操作
实验现象
1
将FeCl3溶液加热片刻
溶液颜色变深
2
向FeCl3 溶液中通入少量HCl气体
溶液颜色变浅
3
向FeCl3溶液中加入少量(NH4)2SO4固体
溶液颜色变浅
4
向FeCl3溶液中加入少量NaHCO3固体
产生红褐色沉淀,溶液中出现大量气泡
下列有关说法正确的是( )
A、实验1得到的溶液中有c(Cl-)>c(Fe3+)>c(OH-)>c(H+) B、实验2中FeCl3水解反应的化学平衡常数变小 C、实验3得到的溶液中有3c(Fe3+)+c(H+)=c(NH3·H2O)+c(Cl-)+c(OH-) D、实验4中反应的离子方程式为Fe3++ +H2O=Fe(OH)3↓+CO2↑13. 工业上可用“丙烯氨氧化法”生产重要的化工原料丙烯腈(C3H3N)。①在催化剂存在下生成丙烯腈(C3H3N)的热化学方程式为C3H6(g)+NH3(g)+3/2O2(g)=C3H3N(g)+3H2O(g) ΔH=-515 kJ/mol
②得到副产物丙烯醛(C3H4O)的热化学方程式为C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
丙烯腈产率与反应温度的关系曲线如图所示。
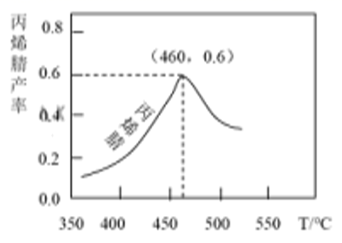
下列说法错误的是( )
A、反应①的平衡常数可表示为K= B、增大压强可以提高丙烯腈的平衡产率 C、温度低于460℃时,丙烯腈的产率不是对应温度下的平衡产率 D、C3H4O(g)+NH3(g)+ O2(g)=C3H3N(g)+2H2O(g) ΔH=-162 kJ/mol二、非选择题
-
14. 工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3)制备镍并回收副产物黄铵铁矾[(NH4)2Fe6(SO4)4(OH)12]的工艺流程如下。
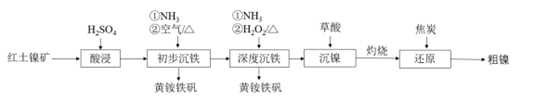 (1)、“初步沉铁”中,向酸浸后的溶液中通入NH3调节溶液的pH至1.5左右,溶液温度保持80℃左右,鼓入空气,一段时间后沉淀出黄铵铁矾。鼓入的“空气”的作用是。(2)、“深度沉铁”中,通入NH3调节溶液pH,溶液温度保持65℃左右,加入H2O2溶液,反应1h后黄铵铁矾沉淀趋于完全。
(1)、“初步沉铁”中,向酸浸后的溶液中通入NH3调节溶液的pH至1.5左右,溶液温度保持80℃左右,鼓入空气,一段时间后沉淀出黄铵铁矾。鼓入的“空气”的作用是。(2)、“深度沉铁”中,通入NH3调节溶液pH,溶液温度保持65℃左右,加入H2O2溶液,反应1h后黄铵铁矾沉淀趋于完全。①溶液中Fe3+转化为黄铵铁矾的离子方程式为。
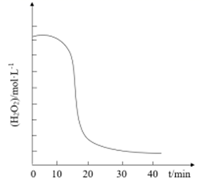
②溶液中c(H2O2)随时间t的变化关系如图所示,反应开始10~20 min内c(H2O2)迅速减小,其原因是。
 (3)、“深度沉铁”时溶液保持的温度比“初步沉铁”时溶液保持的温度低,其原因是。(4)、已知几种金属离子的氢氧化物开始沉淀和沉淀完全时的pH如下表所示(金属离子的起始浓度0.1mol·L-1)。
(3)、“深度沉铁”时溶液保持的温度比“初步沉铁”时溶液保持的温度低,其原因是。(4)、已知几种金属离子的氢氧化物开始沉淀和沉淀完全时的pH如下表所示(金属离子的起始浓度0.1mol·L-1)。金属离子的氢氧化物
Ni(OH)2
Fe(OH)3
黄铵铁矾
开始沉淀pH
7.1
2.7
1.3
沉淀完全pH
9.2
3.7
2.3
“深度沉铁”中通入NH3调节溶液pH的范围是。
15. 化合物G是抗2019-nCOV病毒药物 remde-sivir的中间体,其一种合成路线如下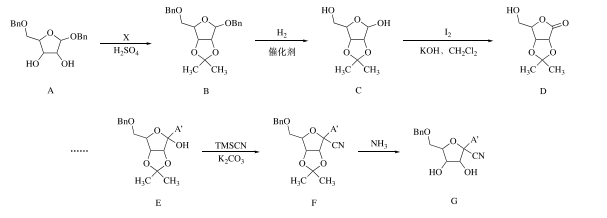
(注Bn:
 ;A':腺嘌呤类似物基团;TMSCN:
;A':腺嘌呤类似物基团;TMSCN:  )(1)、C→D的反应类型为。(2)、一个C分子中含有手性碳原子的数目为。(3)、X的分子式为C5H12O2 , A+X B+2CH3OH,则X的结构简式为。(4)、D的一种同分异构体同时满足下列条件,写出该同分异构体的一种结构简式。
)(1)、C→D的反应类型为。(2)、一个C分子中含有手性碳原子的数目为。(3)、X的分子式为C5H12O2 , A+X B+2CH3OH,则X的结构简式为。(4)、D的一种同分异构体同时满足下列条件,写出该同分异构体的一种结构简式。①分子中有一个含一个氧原子的六元环
②分子中有五种不同环境的氢原子
③能发生银镜反应、水解反应
(5)、设计以 和X为原料制备
和X为原料制备  的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干) 。 16. 碘是人体不可缺少的微量元素,也是制造各种无机及有机碘化物的重要原料。利用卤水(含有F)可提取碘。(1)、采用离子交换法从卤水中提取碘的工艺流程如下:
的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干) 。 16. 碘是人体不可缺少的微量元素,也是制造各种无机及有机碘化物的重要原料。利用卤水(含有F)可提取碘。(1)、采用离子交换法从卤水中提取碘的工艺流程如下: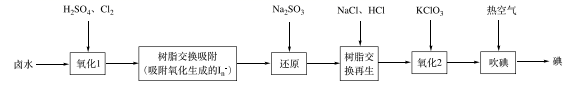
①“氧化1”中生成 ,其反应的离子方程式为。
②“还原”中溶液里含有 , 检验 的实验操作是。
③“吹碘”中通入热空气,利用了碘具有的性质。
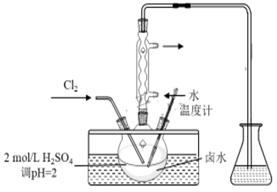
(2)、某实验小组采用如图所示装置、40℃水浴加热制取碘。实验过程中需要控制Cl2用量,否则酸性条件下过量Cl2能将I2进一步氧化成 。请补充完整检验反应后的三颈烧瓶中溶液是否含有 的实验方案:取适量三颈烧瓶中的溶液,。已知反应: +5I-+6H+=3I2+3H2O,实验中可选用的试剂:2mol·L-1硫酸、1 mol·L-1KI溶液、淀粉溶液、CCl4。
 (3)、为测定卤水样品中I的含量,进行下列实验:
(3)、为测定卤水样品中I的含量,进行下列实验:①取2.500L卤水样品减压浓缩至20.00mL,加入过量的0.1500mol·L-1CuCl2溶液20.00mL。
②密封静置2h,生成白色沉淀(发生反应为2Cu2++4I-=I2+2CuI↓)。
③用电感耦合等离子体发射光谱仪测定反应后溶液中c(Cu2+)=0.0125 mol·L-1。
根据上述实验数据,计算卤水样品中I的含量(单位mg·L-1 , 溶液混合前后总体积变化不计,写出计算过程):。
17. 汽车尾气中NOx(NO、NO2等)是形成雾霾及硝酸型酸雨的大气污染物之一、(1)、①尿素[CO(NH2)2]在一定条件下可以直接还原NO生成N2 , 发生反应的化学方程式为。②尿素水溶液高于160℃时水解生成NH3和CO2 , 可作为处理NO反应的氨源。通过调整尿素喷入量与汽车尾气流速,得到相同时间内不同投料比[n(尿素)/n(NO)]时NO的转化率随温度变化的a、b的两条曲线如图1所示。
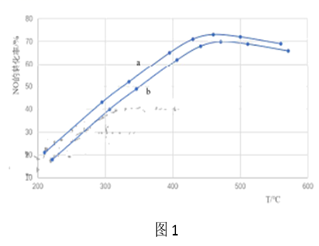
i.曲线a和曲线b,投料比较大的曲线是。(选填“a”或“b”)
ii.当200℃<T<450℃时,NO的转化率随温度升高而增大,原因时温度升高, , 反应速率加快。
(2)、在催化剂Rh表面CO还原NO基元反应机理路径如图2表示,两个N(s)结合生成的N2称为β-N2 , N2O(s)解离生成的N2称为δ-N2 , 基元反应速率随温度的变化关系如图3所示。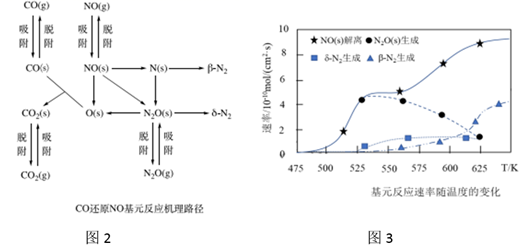
下列说法正确的是_______(填写字母序号)
A、在催化剂表面NO的吸附并解离是反应发生的先决条件 B、在催化剂表面CO2的及时脱附有利于反应的进行 C、当温度超过625K时,生成的N2主要是由CO还原N2O生成的 D、当温度低于530K时,发生的主要反应为2NO+CO=N2O+CO2 E、寻找低温下高效的催化剂控制汽车尾气的污染是未来研究的方向(3)、利用汽车燃油不完全燃烧产物中的CO、HC(还原性的碳氢化合物)作还原剂,在三元催化器作用下可高效去除汽车尾气中的NOx。已知:可燃混合气中空气质量与燃油质量之比为空燃比。CO、HC及NOx转化效率随空燃比的变化关系如图4表示。当空燃比>15时,NOx转化率降低,其可能原因是。