湖南省永州市2021年高考化学二模试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 以下有关垃圾分类说法正确的是( )A、茶叶果皮属于厨余垃圾,可通过转化变为有机氮肥 B、废旧玻璃属于可回收垃圾,其主要成分为新型无机非金属材料 C、食品包装塑料袋属于其他垃圾,其主要成分聚氯乙烯为有机高分子化合物 D、医疗废弃物属于有害垃圾,经过处理、消毒后可加工成儿童玩具2. 下列化学用语错误的是( )A、中子数为10的氧原子: O B、氯化钠的电子式:
 C、CH4的比例模型:
C、CH4的比例模型:  D、乙炔的结构式:H-C≡C-H
3. 下列有关物质的性质与用途不相符合的是( )A、SiO2导电能力强,可用于制造光导纤维 B、ClO2具有强氧化性,可用于自来水的杀菌消毒 C、Na2O2与CO2产生O2 , 可用作呼吸面具供氧剂 D、铁粉具有还原性,可用作食品袋内的抗氧化剂4. 下列关于有机物的说法正确的是( )A、棉花和蚕丝的主要成分都是纤维素 B、煤的气化、液化都是物理变化 C、石油裂化主要是为了得到更多的轻质油 D、硫酸钠浓溶液或福尔马林都能使蛋白质变性5. 下列有关实验说法正确的是( )A、酒精灯加热烧瓶时不用垫石棉网 B、金属钠着火时,可用细沙覆盖灭火 C、可用蒸馏的方法分离乙醇(沸点78.3℃)和苯(沸点80.1℃) D、用容量瓶配制溶液,若加水超过刻度线,可用滴管吸出多余液体6. 设NA表示阿伏加德罗常数的值。下列叙述正确的是( )A、pH=1的H2SO4溶液,含H+的数目为NA B、78 g苯含有碳碳双键的数目为3NA C、11.2L(标准状况)正戊烷含有的分子数目为0.5NA D、1 mol CH3COONa溶于稀醋酸,溶液呈中性时含CH3COO-数目为NA7. 下列离子方程式正确的是( )A、用稀硝酸溶解铜:Cu+2NO +2H+=Cu2++2NO2↑+H2O B、硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO +2H2O C、海带灰浸出液中滴加硫酸酸化的过氧化氢溶液:2I-+H2O2+2H+=I2+2H2O D、碳酸氢钠溶液与过量澄清石灰水混合:2HCO +Ca2++2OH-=CaCO3↓+2H2O+CO8. 分子式为C8H8O2的含苯环有机物,能与NaHCO3溶液反应生成气体,则符合上述条件的同分异构体有(不考虑立体异构)( )A、2种 B、3种 C、4种 D、5种9. 烷烃与氯气的取代反应属于常见的自由基反应,其中甲烷反应的部分历程如下:
D、乙炔的结构式:H-C≡C-H
3. 下列有关物质的性质与用途不相符合的是( )A、SiO2导电能力强,可用于制造光导纤维 B、ClO2具有强氧化性,可用于自来水的杀菌消毒 C、Na2O2与CO2产生O2 , 可用作呼吸面具供氧剂 D、铁粉具有还原性,可用作食品袋内的抗氧化剂4. 下列关于有机物的说法正确的是( )A、棉花和蚕丝的主要成分都是纤维素 B、煤的气化、液化都是物理变化 C、石油裂化主要是为了得到更多的轻质油 D、硫酸钠浓溶液或福尔马林都能使蛋白质变性5. 下列有关实验说法正确的是( )A、酒精灯加热烧瓶时不用垫石棉网 B、金属钠着火时,可用细沙覆盖灭火 C、可用蒸馏的方法分离乙醇(沸点78.3℃)和苯(沸点80.1℃) D、用容量瓶配制溶液,若加水超过刻度线,可用滴管吸出多余液体6. 设NA表示阿伏加德罗常数的值。下列叙述正确的是( )A、pH=1的H2SO4溶液,含H+的数目为NA B、78 g苯含有碳碳双键的数目为3NA C、11.2L(标准状况)正戊烷含有的分子数目为0.5NA D、1 mol CH3COONa溶于稀醋酸,溶液呈中性时含CH3COO-数目为NA7. 下列离子方程式正确的是( )A、用稀硝酸溶解铜:Cu+2NO +2H+=Cu2++2NO2↑+H2O B、硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO +2H2O C、海带灰浸出液中滴加硫酸酸化的过氧化氢溶液:2I-+H2O2+2H+=I2+2H2O D、碳酸氢钠溶液与过量澄清石灰水混合:2HCO +Ca2++2OH-=CaCO3↓+2H2O+CO8. 分子式为C8H8O2的含苯环有机物,能与NaHCO3溶液反应生成气体,则符合上述条件的同分异构体有(不考虑立体异构)( )A、2种 B、3种 C、4种 D、5种9. 烷烃与氯气的取代反应属于常见的自由基反应,其中甲烷反应的部分历程如下:①引发Cl2→Cl +Cl 等
②链反应Cl +CH4→CH3 +HCl CH3 +Cl2→Cl +CH3Cl 等
③终止Cl +Cl →Cl2 Cl + CH3→CH3Cl 等
以下说法错误的是( )
A、引发时可以通过热辐射、光照等条件 B、链反应可以周而复始、反复进行 C、产物中将出现CH3CH3 D、有机产物只有四种10. 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其结构示意图如下(实线代表共价键,其他重复单元的W、X未标注),W、X、Z分别位于不同周期,Z的原子半径在同周期中最大。下列说法错误的是( ) A、Y单质的氧化性在同族中最强 B、Z与Y可能组成多种离子化合物 C、Z的简单离子半径大于Y的简单离子 D、Y的气态氢化物热稳定性大于X的气态氢化物11. 下列实验操作和现象与实验结论一定正确的是( )
A、Y单质的氧化性在同族中最强 B、Z与Y可能组成多种离子化合物 C、Z的简单离子半径大于Y的简单离子 D、Y的气态氢化物热稳定性大于X的气态氢化物11. 下列实验操作和现象与实验结论一定正确的是( )实验操作和现象
实验结论
A
加入少量硫酸铜可加快锌与稀硫酸的反应速率
Cu2+是该反应的催化剂
B
向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝
无法证明溶液X中是否存在NH
C
将苯加入到橙色的溴水中,充分振荡后静置,下层液体几乎无色
苯与Br2发生了取代反应
D
向淀粉水解后的溶液中加入碘水,溶液变蓝色
淀粉没有水解
A、A B、B C、C D、D二、多选题
-
12. 以食盐等为原料制备六水合高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如下:

下列说法正确的是( )
A、“电解Ⅰ”时阳极可用不锈钢材质 B、“歧化反应”的产物之一为NaClO4 C、“操作a”是过滤 D、“反应Ⅱ”的离子方程式为Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O13. 双极膜(BP)是阴、阳复合膜,在直流电作用下,阴、阳膜复合层间的H2O解离成H+和OH-。利用双极膜电渗析法和惰性电极电解食盐水可获得淡水、NaOH溶液和盐酸,其工作原理如下图所示,M、N为离子交换膜。下列说法错误的是( )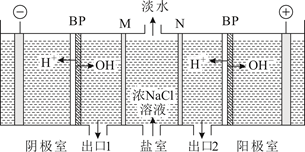 A、M膜为阴离子交换膜 B、出口2的产物是盐酸 C、若去掉双极膜(BP),阳极室会有Cl2生成 D、电路中每转移1 mol电子,两极共得到0.5 mol气体14. 25℃时,0.10 L某二元弱酸H2A用1.00 mol·L-1NaOH溶液调节其pH,溶液中H2A、HA-及A2-的物质的量浓度变化如图所示:
A、M膜为阴离子交换膜 B、出口2的产物是盐酸 C、若去掉双极膜(BP),阳极室会有Cl2生成 D、电路中每转移1 mol电子,两极共得到0.5 mol气体14. 25℃时,0.10 L某二元弱酸H2A用1.00 mol·L-1NaOH溶液调节其pH,溶液中H2A、HA-及A2-的物质的量浓度变化如图所示: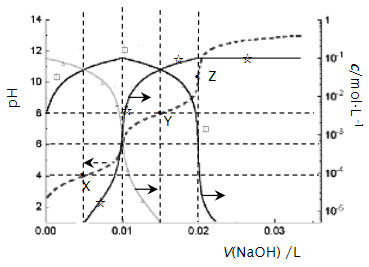
下列说法错误的是( )
A、H2A的Ka1=1×10-4 B、溶液在X点和Z点时水的电离程度相同 C、在Y点时,c(Na+)>3c(A2-) D、0.1 mol·L-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)三、非选择题
-
15. 实验室利用SO2合成硫酰氯(SO2Cl2),并对H2SO3和HClO的酸性强弱进行探究。(1)、Ⅰ.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成SO2和Cl2.实验室合成SO2Cl2的原理:SO2(g)+Cl2(g) SO2Cl2(l) ΔH<0,实验装置如图所示(夹持仪器已省略),请回答下列问题:

装置A中的试剂是。
(2)、活性炭的作用是。(3)、在冰水浴中制备SO2Cl2的原因是。(4)、为了测定SO2Cl2产品纯度(杂质不参与反应),称取a g SO2Cl2产品于锥形瓶中,加入足量蒸馏水,充分反应。用c mol·L-1 AgNO3溶液滴定反应后的溶液,滴几滴K2CrO4溶液做指示剂,当生成Ag2CrO4砖红色沉淀时,认为溶液中Cl-沉淀完全,此时消耗AgNO3溶液的体积为V mL。①用棕色滴定管盛装AgNO3溶液,其原因是。
②该SO2Cl2产品的纯度为。
(5)、Ⅱ.选用下面的装置探究酸性:H2SO3>HClO,其连接顺序为A→。能证明H2SO3的酸性强于HClO的实验现象为。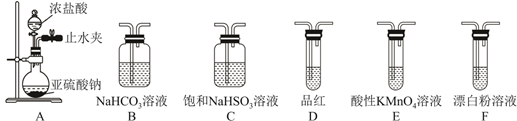 16. 明代《天工开物》记载了“火法”炼锌方法:“炉甘石(碳酸锌)十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,…,发火煅红,…,毁罐取出,即倭铅也”。现代工业开发了用NH3—NH4Cl水溶液浸出氧化锌烟灰(主要成分为ZnO 、Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
16. 明代《天工开物》记载了“火法”炼锌方法:“炉甘石(碳酸锌)十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,…,发火煅红,…,毁罐取出,即倭铅也”。现代工业开发了用NH3—NH4Cl水溶液浸出氧化锌烟灰(主要成分为ZnO 、Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。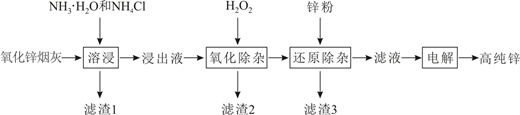
已知浸出液含[Zn(NH3)4]2+、[Cu(NH3)4]2+、AsCl 。
(1)、《天工开物》记载的炼锌方法要求罐体用泥封严,目的是。(2)、滤渣1的主要成分是(填化学式)。一段时间内锌浸出率与温度的关系如图所示,分析出现该现象的原因。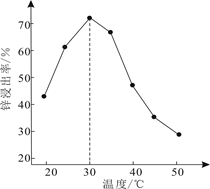 (3)、“氧化除杂”的目的是将AsCl 转化为As2O5胶体,再经吸附聚沉除去,溶液始终接近中性,该反应的离子方程式是。(4)、“电解”含[Zn(NH3)4]2+的溶液,阴极电极反应式是。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是(填化学式)。(5)、ZnCl2溶液在T1℃水解可得某碱式盐,取11.38g该碱式盐,T2℃完全水解后并煅烧,可得纯氧化锌8.1g。则该碱式盐的化学式为。17. 据统计,约有90%以上的工业过程中需要使用催化剂,因此,对催化剂的研究已成为重要课题。(1)、I.结合实验与计算机模拟结果,研究了N2与H2在固体催化剂表面合成NH3的反应历程。图示为反应历程中的势能面图(部分数据省略),其中吸附在催化剂表面的物种用*标注。
(3)、“氧化除杂”的目的是将AsCl 转化为As2O5胶体,再经吸附聚沉除去,溶液始终接近中性,该反应的离子方程式是。(4)、“电解”含[Zn(NH3)4]2+的溶液,阴极电极反应式是。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是(填化学式)。(5)、ZnCl2溶液在T1℃水解可得某碱式盐,取11.38g该碱式盐,T2℃完全水解后并煅烧,可得纯氧化锌8.1g。则该碱式盐的化学式为。17. 据统计,约有90%以上的工业过程中需要使用催化剂,因此,对催化剂的研究已成为重要课题。(1)、I.结合实验与计算机模拟结果,研究了N2与H2在固体催化剂表面合成NH3的反应历程。图示为反应历程中的势能面图(部分数据省略),其中吸附在催化剂表面的物种用*标注。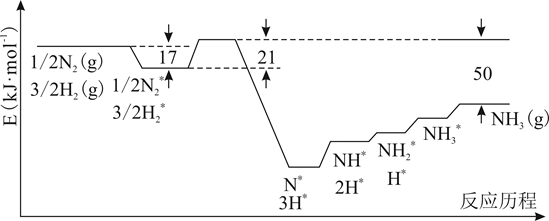
氨气的脱附是(填“吸热”或“放热”)过程,合成氨的热化学方程式为。
(2)、当使用铁催化剂时,合成氨的速率方程式为w = k1•p(N2) -k2 ,其中w为反应的瞬时总速率,等于正反应速率和逆反应速率之差,k1、k2是正、逆反应速率常数,则合成氨反应N2+3H2 2NH3的平衡常数Kp=(用k1、k2表示)。(3)、在使用同一催化剂时,将2.0molN2和6.0molH2 通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2时n(H2)的变化,曲线B表示T1时n(NH3)的变化,T2时反应到a点恰好达到平衡。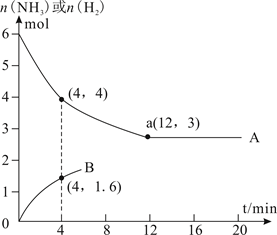
①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时v(正)v(逆)(填“>”、“<”或“=”)。
②能否由图中数据得出温度T1>T2 , 试说明理由。
(4)、Ⅱ.用催化剂Fe3(CO)12/ZSM-5催化CO2加氢合成乙烯的过程中,还会生成CH4、C3H6、C4H8等副产物,若在催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性(选择性指的是转化的CO2中生成C2H4的百分比)。在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表:助剂
CO2转化率(%)
各产物在所有产物中的占比(%)
C2H4
C3H6
其他
Na
42.5
35.9
39.6
24.5
K
27.2
75.6
22.8
1.6
Cu
9.8
80.7
12.5
6.8
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是。
18. 钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、生物材料等领域。钛的氯化物有如下转变关系:2TiCl3 TiCl4↑+TiCl2 , 回答下列问题:(1)、基态钛原子的价电子排布式为。与钛同周期的第ⅡB族和ⅢA族两种元素中第一电离能较大的是(写元素符号),原因是。(2)、钛的氯化物的部分物理性质如下表:氯化物
熔点/℃
沸点/℃
溶解性
TiCl4
-24
136
可溶于非极性的甲苯和氯代烃
TiCl2
1035
1500
不溶于氯仿、乙醚
①TiCl4与TiCl2的晶体类型分别是、。
②TiCl4与 互为等电子体,因为它们相同; 中心原子的杂化方式是。
(3)、Ti的配合物有多种。 的配体所含原子中电负性最小的是; 的球棍结构如图Ⅰ,Ti的配位数是。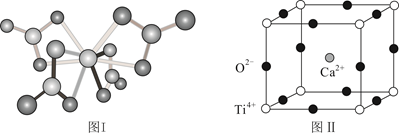 (4)、钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ。
(4)、钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ。①设NA为阿伏加德罗常数的值,计算一个晶胞的质量为g。
②假设O2-采用面心立方最密堆积,Ti4+与O2-相切,则 。
19. M是一种双功能手性催化剂,在药物合成中具有重要作用,其合成路线如下:
已知:R-NH2+


回答下列问题:
(1)、A的化学名称为;C中官能团的名称。(2)、③的反应类型是。(3)、设计反应①、②的目的是。(4)、写出反应①的化学方程式。(5)、M中含有个手性碳原子。(6)、写出一种符合下列要求C的同分异构体的结构简式。i.能发生银镜反应
ii.分子中含有三种化学环境不同的氢原子
iii. 不存在
 结构(7)、设计由乙二醇和对苯二胺(
结构(7)、设计由乙二醇和对苯二胺( )制备
)制备  )的合成路线(无机试剂任选) 。
)的合成路线(无机试剂任选) 。