广东省珠海市2021年高考化学一模试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 我国在科技上不断取得重大成果,下列说法正确的是( )A、嫦娥五号月面五星红旗的面料“芳纶”属于合成纤维 B、嫦娥五号登月采集的样本中含有3He,与地球上的2He 互为同素异形体 C、我国开采的海底可燃冰是可以燃烧的水 D、中国“奋斗者”号万米载人潜水器的钛合金材料属于新型高分子材料2. 2020国际陶瓷产业博览会在湖南(醴陵)开幕,以下关于陶瓷说法正确的是( )A、CaCO3是陶瓷的主要成分 B、烧结黏土制陶瓷属于物理变化 C、“雨过天晴云破处”所描述瓷器的青色与氧化铁有关 D、某种硅酸盐的主要成分为KAlSi3O8 , 用氧化物形式表示为3. 下列说法正确的是( )A、N2O5属于酸性氧化物 B、蔗糖和铁都属于非电解质 C、CO2、SO2、NO2均为空气污染物 D、氧化钙常用在食品袋中做“去氧剂”4. 下列有关化学用语表示错误的是( )A、葡萄糖的最简式CH2O B、质量数为18的氧原子:18O C、NaClO 的电子式:
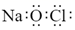 D、2-丁烯的结构简式: CH3CH=CHCH3
5. 设 NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、常温下,78g Na2O2中含有离子数为 4NA B、0.5mol/L 的 AlCl3溶液中所含 Al3+的数目小于 0.5NA C、1mol Cl2与过量 H2O 反应,转移的电子数目为NA D、标准状况下,11.2L N2和 NO 混合气体中的原子数为NA6. 羟甲香豆素(MSDS)又称利胆通,是一种新型利胆药物,常用作医药中间体,有关MSDS下列说法正确的是( )
D、2-丁烯的结构简式: CH3CH=CHCH3
5. 设 NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、常温下,78g Na2O2中含有离子数为 4NA B、0.5mol/L 的 AlCl3溶液中所含 Al3+的数目小于 0.5NA C、1mol Cl2与过量 H2O 反应,转移的电子数目为NA D、标准状况下,11.2L N2和 NO 混合气体中的原子数为NA6. 羟甲香豆素(MSDS)又称利胆通,是一种新型利胆药物,常用作医药中间体,有关MSDS下列说法正确的是( ) A、该物质属于芳香烃 B、可发生氧化反应 C、不能使酸性高锰酸钾溶液褪色 D、1mol该物质最多能与3molH2发生加成反应7. 下列关于物质的性质和应用的说法正确的是( )A、绿矾的化学式为 FeSO4·7H2O,可用作补血剂 B、从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝 C、泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 D、用 Na2S 作还原剂,除去水中的 Cu2+和 Hg2+8. 用下列装置进行相应的实验,不能达到实验目的的是( )
A、该物质属于芳香烃 B、可发生氧化反应 C、不能使酸性高锰酸钾溶液褪色 D、1mol该物质最多能与3molH2发生加成反应7. 下列关于物质的性质和应用的说法正确的是( )A、绿矾的化学式为 FeSO4·7H2O,可用作补血剂 B、从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝 C、泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 D、用 Na2S 作还原剂,除去水中的 Cu2+和 Hg2+8. 用下列装置进行相应的实验,不能达到实验目的的是( )A
B
C
D
用此装置提纯I2
用标准KMnO4溶液测定待测液Na2C2O4物质的量浓度
观察气泡鉴别乙醇与甲醚(CH3OCH3)
制取并收集干燥纯净的NH3



 A、A B、B C、C D、D9. 在酸性溶液中能大量共存且为无色透明溶液的是( )A、 B、 C、 D、10. 下列叙述正确的是( )A、稀醋酸中加入少量浓醋酸能增大醋酸的电离程度 B、若NH4Cl溶液与 NH4HSO4溶液的 相等,则 C、向盐酸中加入氨水至中性,溶液中 D、AgCl固体在100mL 0.01mol/L NaCl溶液中的 Ksp比在100mL 0.01moL BaCl2中的Ksp大11. 原子序数依次增大的短周期元素 X、Y、Z、R,含 0.9%YR的水溶液称为生理盐水,X、Y、Z三种元素组成两种化合物 A、B 的性质如图,Z的质子数是X质子数的2 倍。下列说法正确的是( )
A、A B、B C、C D、D9. 在酸性溶液中能大量共存且为无色透明溶液的是( )A、 B、 C、 D、10. 下列叙述正确的是( )A、稀醋酸中加入少量浓醋酸能增大醋酸的电离程度 B、若NH4Cl溶液与 NH4HSO4溶液的 相等,则 C、向盐酸中加入氨水至中性,溶液中 D、AgCl固体在100mL 0.01mol/L NaCl溶液中的 Ksp比在100mL 0.01moL BaCl2中的Ksp大11. 原子序数依次增大的短周期元素 X、Y、Z、R,含 0.9%YR的水溶液称为生理盐水,X、Y、Z三种元素组成两种化合物 A、B 的性质如图,Z的质子数是X质子数的2 倍。下列说法正确的是( ) A、简单氢化物沸点 Z>X B、简单离子半径 X<Y<Z<R C、Y与X形成的一种化合物含有离子键和非极性键 D、化合物 A 和 B的水溶液皆呈中性12. 根据下列实验操作和现象所得出的结论正确的是( )
A、简单氢化物沸点 Z>X B、简单离子半径 X<Y<Z<R C、Y与X形成的一种化合物含有离子键和非极性键 D、化合物 A 和 B的水溶液皆呈中性12. 根据下列实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
结论
A
向3mLKI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色
Br2的氧化性比I2的强
B
向蛋白质溶液中分别加入甲醛和 饱和溶液,均有固体析出
蛋白质均发生了变性
C
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于碳酸的酸性
D
向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀
气体X具有强氧化性
A、A B、B C、C D、D13. 某NH3传感器工作原理如图所示(其中固体电解质允许 O2-发生迁移),下列说法正确的是( ) A、传感器的内外电路中,电流均是由电子定向移动形成的 B、传感器工作时,O2参与的电极反应式为: C、传感器工作时,负极上 NH3 被消耗,pH 会降低 D、传感器工作时,每消耗 3mol O2 , 生成 2mol N214. 硫化氢与甲醇合成甲硫醇的催化过程如下,下列说法中正确的是( )
A、传感器的内外电路中,电流均是由电子定向移动形成的 B、传感器工作时,O2参与的电极反应式为: C、传感器工作时,负极上 NH3 被消耗,pH 会降低 D、传感器工作时,每消耗 3mol O2 , 生成 2mol N214. 硫化氢与甲醇合成甲硫醇的催化过程如下,下列说法中正确的是( )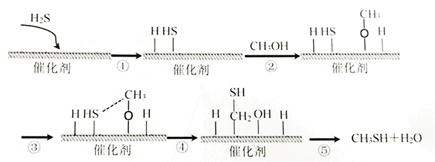 A、过程①放出能量 B、过程④中,只形成了C—S 键 C、硫化氢与甲醇合成甲硫醇的反应类型为取代反应 D、该催化剂可降低反应活化能,反应前后没有变化,并没有参加反应15. 部分含氯物质的分类与相应氯元素的化合价关系下图所示。下列说法错误的是( )
A、过程①放出能量 B、过程④中,只形成了C—S 键 C、硫化氢与甲醇合成甲硫醇的反应类型为取代反应 D、该催化剂可降低反应活化能,反应前后没有变化,并没有参加反应15. 部分含氯物质的分类与相应氯元素的化合价关系下图所示。下列说法错误的是( ) A、a 与d,a与e在酸性情况下反应,均可以得到b B、c 为一种新型自来水消毒剂,代替 b的原因是:c的毒性更小 C、b 的水溶里加入 CaCO3 , 可以增加d的产量 D、消毒液可用于环境消毒,主要是因为含有d,e的固体可用于实验室制O216. 常温下,往20mL 0.10mol/L HA溶液中滴加0.10mol/L KOH溶液,所得混合溶液中水电离的H+浓度和所加的 KOH 溶液体积变化趋势如图所示,下列有关说法错误的是( )
A、a 与d,a与e在酸性情况下反应,均可以得到b B、c 为一种新型自来水消毒剂,代替 b的原因是:c的毒性更小 C、b 的水溶里加入 CaCO3 , 可以增加d的产量 D、消毒液可用于环境消毒,主要是因为含有d,e的固体可用于实验室制O216. 常温下,往20mL 0.10mol/L HA溶液中滴加0.10mol/L KOH溶液,所得混合溶液中水电离的H+浓度和所加的 KOH 溶液体积变化趋势如图所示,下列有关说法错误的是( ) A、该酸的电离度约为1% B、b 点:溶液存在 C、c点: 溶液存在 D、d 点: pH=7
A、该酸的电离度约为1% B、b 点:溶液存在 C、c点: 溶液存在 D、d 点: pH=7二、非选择题
-
17. FeCl2广泛应用于织物印染,医药,冶金和照相等行业。某实验小组设计如下装置利用H2和 FeCl3制备 FeCl2 , 从左侧缓缓通入H2。
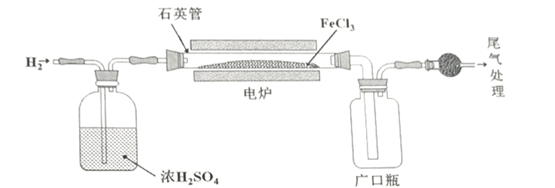
已知有关物质的性质如下:
FeCl3
FeCl2
Fe
熔点/℃
升华,易水解
672
1538
沸点/℃
1023
2750
(1)、浓硫酸在实验中有两个作用: ①除去水,使得通入的氢气干燥。②。(2)、球形干燥管中盛放的物质为:。(3)、实验过程中,探究电炉温度(T)对产物的影响。①当温度T为300℃时,加热一段时间后发现石英管内几乎没有固体剩余,请指出出现该现象可能的原因:。
②当温度T为 330℃时,加热后石英管内有固体剩余,取少量固体于试管中并加入稀盐酸,全部溶解且无气泡,对固体成分进行猜测并设计实验验证。
猜测1:只有 FeCl2;猜测2: 含有FeCl2和 FeCl3;猜测3: 只有FeCl3
实验方案:
实验步骤
操作
现象
第一步
取溶液2mL于试管中,加入KSCN
现象一
第二步
另取溶液2mL于试管中,加入
现象二
第二步加入的物质为:。
实验结论:现象一为 , 现象二为。则猜测1 成立。
③当温度T为350℃时,加热后石英管内有固体剩余,取少量固体于试管中并加入稀盐酸,固体溶解的同时有少量气泡产生,写出加热过程中发生的副反应的化学方程式:。
(4)、三次实验中,广口瓶中都可以收集到大量固体,则其成分主要为。18. 铋是一种稀有金属,铋及其化合物在工业生产中用途广泛,如氯氧化铋常用于电子设备、汽车装饰材料、塑料助剂及生产干电池阴极。以下是一种用铋精矿(主要成分是Bi2S3还含有FeS2、 Cu2S、PbO2及不溶性杂质)制备 BiOCl的一种方法,其流程如图: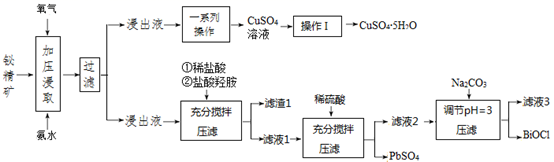 已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题:
(1)、铋精矿在浸取时会先进行粉碎,目的是。(2)、加压氧化氨浸过程中,已知 CuS2发生如下反应: , 生成 ,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式。(3)、操作Ⅰ为:。(4)、根据流程分析,盐酸羟胺在反应中起到什么作用:。(5)、流程中生成 BiOCl 的离子方程式:。(6)、滤液 3 中含有的金属阳离子有:。19. 氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:(1)、查阅资料: 标准摩尔生成焓是指在 25℃和101kPa时,由元素最稳定的单质生成 1mol纯化合物时的焓变,符号为 。已知以下物质的标准摩尔生成焓如下表所示。物质
-46
-242
由此可得 = 。
(2)、氨气的催化氧化是工业制取硝酸的重要步骤,假设只会发生以下两个竞争反应Ⅰ、Ⅱ。反应I:
反应Ⅱ:
为分析某催化剂对该反应的选择性,将 1mol NH3和2mol O2充入1 L密闭容器中,在不同温度相同时间下,测得有关物质的量关系如图。

①该催化剂在低温时对反应(填“Ⅰ”或“Ⅱ”)的选择性更好。
②520℃时,容器中为 c(NH3)=mol/L,该温度下反应 的平衡常数K=(不要求得出计算结果,只需列出有具体数字的计算式)。
③高于840℃时,NO 的产率降低的可能原因是(填选项字母)。
A. NH3溶于水 B. 反应活化能增大
C.反应I的平衡常数变小 D. 催化剂活性降低
(3)、NH3也是造成水体富营养化的重要原因之一,用 NaClO 溶液氧化可除去氨氮。其反应机理如图1所示(其中H2O 和 NaCl 略去)。
①NaClO 氧化 NH3的总反应的化学方程式为。
②改变 对溶液中NaClO去除氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图2 所示,则除氨氮过程中最佳的 值约为。
③为了提高氨氮的去除率,在实际工艺过程中温度控制在 15℃~30℃时,其可能的原因是:。
20. B、Si和P 是组成半导体材料的重要元素。回答下列问题(1)、基态B、Si 和P中,单电子数最多的是 , 电负性最大的是。(2)、PCl3中心原子的杂化类型为 , BCl3与阴离子互为等电子体。(3)、SiCl4 极易与水反应,其反应机理如图。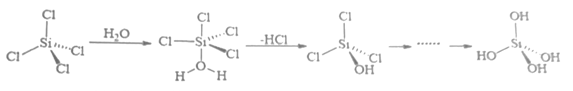
①上述反应机理涉及的分子中属于非极性分子的是。(填化学式)
②关于上述反应机理的说法正确的是。
A. Si 的杂化方式一直没有发生变化
B. H2O 中 O 通过孤对电子与 Si 形成配位键
C.只涉及了极性共价键的断裂与形成
(4)、两种含硅化合物的晶胞结构如图所示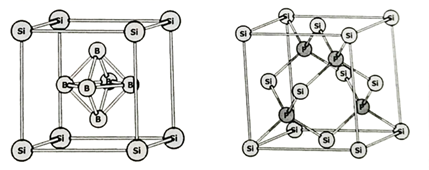
I Ⅱ
①这两种含硅化合物的化学式分别为和。
②I的晶胞参数为a pm,则Ⅰ的密度为 。
③Ⅱ的晶胞参数为b pm,Si和P的原子半径分别为 pm和 pm,则Ⅱ的空间占有率为。
21. 阿比朵尔是治疗新冠状病毒肺炎的药物之一,其中间体的合成路线如下: (1)、A 的分子式;B的官能团名称。(2)、由B生成C的反应类型是。(3)、步骤④中原料X的分子式是 ,X的结构简式是。(4)、下列关于F的性质正确的是___________(填字母符号)。A、易溶于水 B、最多能与 4mol H2发生加成反应 C、可以使溴水褪色 D、最多有6个碳原子共平面(5)、满足以下条件的 D 的同分异构体共还有种:
(1)、A 的分子式;B的官能团名称。(2)、由B生成C的反应类型是。(3)、步骤④中原料X的分子式是 ,X的结构简式是。(4)、下列关于F的性质正确的是___________(填字母符号)。A、易溶于水 B、最多能与 4mol H2发生加成反应 C、可以使溴水褪色 D、最多有6个碳原子共平面(5)、满足以下条件的 D 的同分异构体共还有种:①苯环上有两个取代基且-NH2直接连在苯环上: ②能与氢氧化钠水溶液反应;写出其中核磁共振氢谱中峰面积之比 1:2:2:2:2的一种结构简式: 。
(6)、写出G与氢氧化钠水溶液反应的化学方程式。