广东省汕头市2021年高考化学一模试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 2020 年,我国自主研制长征五号火箭“胖五”将嫦娥五号送入地月轨道并顺利从月球带回月壤。下列有关说法错误的是( )A、“胖五”用液氧、液氢作推进剂,在发射过程中发生氧化还原反应 B、“胖五”外壳为铝合金材料,其优点是熔点高、硬度大 C、月壤中可能含有未来能源材料3He,其中子数为 1 D、3He 与 4He 互为同位素2. 下列没有发生化学变化的是( )A、用活性炭吸附色素 B、用高粱酿制白酒 C、用维生素C缓解亚硝酸盐中毒 D、用脱硫石膏改良盐碱地3. 化学与人类生活、科技发展密切相关,下列有关说法正确的是( )A、华为 5G 芯片巴龙 5000 的主要材料是硅酸盐 B、生产 N95 口罩的聚丙烯能使酸性高锰酸钾溶液褪色 C、推广使用聚碳酸酯可降解塑料有利于保护环境,减少白色污染 D、中国天眼用到的高性能材料碳化硅是一种新型的有机高分子材料4. 古诗词是古人留给我们的精神财富,其中蕴含了许多化学知识,下列有关表述正确的是( )A、“春蚕到死丝方尽”中的“丝”为蛋白质,不易受到酸碱腐蚀 B、“蜡炬成灰泪始干”中“蜡”为油脂,属于天然高分子化合物 C、“九秋风露越窑开,夺得千峰翠色来”描述的越窑青瓷,“翠色”来自于氧化铁 D、“墨滴无声入水惊,如烟袅袅幻形生”中“墨滴”具有胶体的性质5. 下列仪器为高中常见仪器(省略夹持装置),选用下列仪器不能完成的实验是( )
 A、粗盐的提纯(除去泥沙) B、分离乙酸乙酯和饱和碳酸钠溶液 C、酸碱中和滴定 D、用 18.4mol/L 的浓硫酸配制 1mol/L 的稀硫酸6. 为减少环境污染,降低化石燃料消耗,我国正积极推广乙醇汽油。乙醇可由淀粉或纤维素经水解、发酵制得。下列说法错误的是( )A、纤维素的水解反应为取代反应 B、可用乙醇做萃取剂,萃取碘水中的碘单质 C、可用碘液来检验淀粉是否水解完全 D、乙醇可由乙烯与水发生加成反应制取7. 我国“金牌火箭”长征二号用 N2H4做燃料,发生反应:2N2H4+ 2NO2 3N2+4H2O。设 NA 为阿伏加德罗常数的值,下列有关说法正确的是( )A、标准状况下,22.4L H2O 中质子数目为 10 NA B、16g N2H4中含有极性共价键数目为 2.5 NA C、反应生成 1.5molN2时转移的电子数目为 4 NA D、密闭容器中 2molNO 和 1molO2充分反应生成 NO2 , 其分子数目为 2 NA8. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、含有FeCl2的溶液中: 、H+、K+、Ca2+ B、中性溶液中:Fe3+、 、 、 C、澄清透明溶液中:Cu2+、 、Cl-、Mg2+ D、 的溶液中: 、Na+、OH-、S2-9. 北京大学研究员发现在钙钛矿活性层中引入稀土 Eu3+/Eu2+离子对,通过如图原理可消除零价铅和零价碘缺陷,提高钙钛矿太阳能电池的使用寿命。下列说法正确的是( )
A、粗盐的提纯(除去泥沙) B、分离乙酸乙酯和饱和碳酸钠溶液 C、酸碱中和滴定 D、用 18.4mol/L 的浓硫酸配制 1mol/L 的稀硫酸6. 为减少环境污染,降低化石燃料消耗,我国正积极推广乙醇汽油。乙醇可由淀粉或纤维素经水解、发酵制得。下列说法错误的是( )A、纤维素的水解反应为取代反应 B、可用乙醇做萃取剂,萃取碘水中的碘单质 C、可用碘液来检验淀粉是否水解完全 D、乙醇可由乙烯与水发生加成反应制取7. 我国“金牌火箭”长征二号用 N2H4做燃料,发生反应:2N2H4+ 2NO2 3N2+4H2O。设 NA 为阿伏加德罗常数的值,下列有关说法正确的是( )A、标准状况下,22.4L H2O 中质子数目为 10 NA B、16g N2H4中含有极性共价键数目为 2.5 NA C、反应生成 1.5molN2时转移的电子数目为 4 NA D、密闭容器中 2molNO 和 1molO2充分反应生成 NO2 , 其分子数目为 2 NA8. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、含有FeCl2的溶液中: 、H+、K+、Ca2+ B、中性溶液中:Fe3+、 、 、 C、澄清透明溶液中:Cu2+、 、Cl-、Mg2+ D、 的溶液中: 、Na+、OH-、S2-9. 北京大学研究员发现在钙钛矿活性层中引入稀土 Eu3+/Eu2+离子对,通过如图原理可消除零价铅和零价碘缺陷,提高钙钛矿太阳能电池的使用寿命。下列说法正确的是( )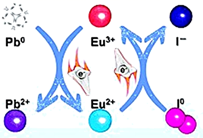 A、Eu3+/Eu2+离子对在反应过程中需定时补充 B、消除零价铅的反应为: C、消除零价碘的过程中,Eu3+/Eu2+离子对发生还原反应 D、整个过程中,电子从 I0转移给 Pb010. 我国化学家侯德榜研究出以饱和食盐水、CO2和 NH3(合成氨厂的氨气中常混有副产物CO2)为原料制备纯碱,其生产流程如下所示,下列说法错误的是( )
A、Eu3+/Eu2+离子对在反应过程中需定时补充 B、消除零价铅的反应为: C、消除零价碘的过程中,Eu3+/Eu2+离子对发生还原反应 D、整个过程中,电子从 I0转移给 Pb010. 我国化学家侯德榜研究出以饱和食盐水、CO2和 NH3(合成氨厂的氨气中常混有副产物CO2)为原料制备纯碱,其生产流程如下所示,下列说法错误的是( ) A、沉淀池中应先通入 NH3 , 再通入 CO2 B、流程中的 X 为 CO2 , Y 为 NH3 C、沉淀池中发生反应: D、操作 I 为过滤,母液中的一种副产品为 NH4Cl,可在农业上用作化肥11. X、Y、Z、W、R 是原子序数依次增大的短周期主族元素,Y 的同位素常用于判定古文物的年代,R 与 Y 位于同一主族,W 的电子层数与主族序数相同,X、Y、Z 组成的化合物甲的球棍模型如图所示,甲在疫情期间可用做消毒剂。下列说法正确的是( )
A、沉淀池中应先通入 NH3 , 再通入 CO2 B、流程中的 X 为 CO2 , Y 为 NH3 C、沉淀池中发生反应: D、操作 I 为过滤,母液中的一种副产品为 NH4Cl,可在农业上用作化肥11. X、Y、Z、W、R 是原子序数依次增大的短周期主族元素,Y 的同位素常用于判定古文物的年代,R 与 Y 位于同一主族,W 的电子层数与主族序数相同,X、Y、Z 组成的化合物甲的球棍模型如图所示,甲在疫情期间可用做消毒剂。下列说法正确的是( ) A、X 与 Y 只能形成两种二元化合物 B、最高价氧化物对应水化物的酸性:R>Y C、原子半径的大小关系:W>R>Z>Y>X D、化合物甲中存在极性共价键、非极性共价键,具有强氧化性12. 柿子中因含有单宁酸而呈现出苦涩味,下图是单宁酸的结构简式,下列说法错误的是( )
A、X 与 Y 只能形成两种二元化合物 B、最高价氧化物对应水化物的酸性:R>Y C、原子半径的大小关系:W>R>Z>Y>X D、化合物甲中存在极性共价键、非极性共价键,具有强氧化性12. 柿子中因含有单宁酸而呈现出苦涩味,下图是单宁酸的结构简式,下列说法错误的是( ) A、单宁酸中含有三种官能团,均可发生取代反应 B、1mol 单宁酸可与 8molH2发生反应 C、单宁酸中所有原子可能位于同一平面 D、将柿子去皮晾晒可使单宁酸与 O2发生作用,从而脱去涩味13. 二氧化碳催化加氢合成乙烯是综合利用 CO2的热点研究领域,对节能减排有重要意义。已知反应:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g),温度对 CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法错误的是( )
A、单宁酸中含有三种官能团,均可发生取代反应 B、1mol 单宁酸可与 8molH2发生反应 C、单宁酸中所有原子可能位于同一平面 D、将柿子去皮晾晒可使单宁酸与 O2发生作用,从而脱去涩味13. 二氧化碳催化加氢合成乙烯是综合利用 CO2的热点研究领域,对节能减排有重要意义。已知反应:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g),温度对 CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法错误的是( ) A、正反应为放热反应 B、化学平衡常数:KM>KN C、当温度高于 250 ℃时,催化剂的催化效率降低是因为平衡逆向移动引起的 D、若初始投料比 n(H2)∶n(CO2)=3∶1,则图中 M 点的乙烯体积分数约为 7.7%14. 下列实验操作、现象与结论都正确的是( )
A、正反应为放热反应 B、化学平衡常数:KM>KN C、当温度高于 250 ℃时,催化剂的催化效率降低是因为平衡逆向移动引起的 D、若初始投料比 n(H2)∶n(CO2)=3∶1,则图中 M 点的乙烯体积分数约为 7.7%14. 下列实验操作、现象与结论都正确的是( )选项
操作
现象
结论
A
往溴水中滴加植物油,振荡
溶液褪色
溴水与植物油发生取代反应
B
将浓硫酸滴到蔗糖表面
固体变黑膨胀
浓硫酸有吸水性和强氧化性
C
在葡萄糖溶液中加入适量新制氢氧化铜悬浊液,加热
产生砖红色沉
葡萄糖具有还原性
D
加热浸透石蜡油的矿物棉,将产生的气体通入酸性高锰酸钾溶液
紫色溶液逐渐变浅
产生的气体一定含有乙烯
A、A B、B C、C D、D15. 2020 年,中国科学院在钠离子电池的研究上取得新突破,其应用领域广、安全性能好,在未来有巨大市场前景。某水系钠离子二次电池总反应为:2NaFePO4F+ Na3Ti2(PO4)3 2Na2FePO4F+ NaTi2(PO4)3 , 下列说法正确的是( ) A、放电时,溶液中的 Na+移向 a 极 B、放电时, C、充电时,Na2FePO4F 发生还原反应 D、充电时,电路中通过 1mol e-时,b 极增重 46g16. 室温下,向 100mL 饱和 H2S 溶液中通入 SO2气体(气体体积换算成标准状况),发生反应: ,测得溶液 pH 与通入 SO2的关系如图。下列有关说法正确的是( )
A、放电时,溶液中的 Na+移向 a 极 B、放电时, C、充电时,Na2FePO4F 发生还原反应 D、充电时,电路中通过 1mol e-时,b 极增重 46g16. 室温下,向 100mL 饱和 H2S 溶液中通入 SO2气体(气体体积换算成标准状况),发生反应: ,测得溶液 pH 与通入 SO2的关系如图。下列有关说法正确的是( )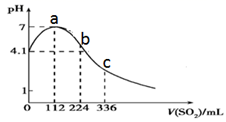 A、溶液的导电性:a>b>c B、整个过程中,水的电离程度先增大后减小 C、该温度下,H2S 的 Ka1数量级为 10-9 D、a 点之后,随 SO2气体的通入, 的值始终减小
A、溶液的导电性:a>b>c B、整个过程中,水的电离程度先增大后减小 C、该温度下,H2S 的 Ka1数量级为 10-9 D、a 点之后,随 SO2气体的通入, 的值始终减小二、非选择题
-
17. 三氯乙醛(CCl3CHO)作为有机原料,常用于生产氯霉素、氯仿等。实验室制备三氯乙醛的装置示意图(加热装置未画出)和有关数据如下:

反应原理:
相关物质的相对分子质量及部分物理性质:
相对原子质量
熔点/℃
沸点/℃
溶解性
CH3CH2OH
46
-114.1
78.3
与水互溶
CCl3CHO
147.5
-57.5
97.8
可溶于水、乙醇
CCl3COOH
163.5
58
198
可溶于水、乙醇、三氯乙醛
回答下列问题:
(1)、仪器 a 的名称是 ,往 a 中加入盐酸,将其缓慢加入到高锰酸钾中,反应的化学方程式: 。(2)、装置 D 的作用是 ,仪器 F 的作用是 ,E 中冷凝水应从 (填“b”或“c”)口进。(3)、反应过程中若存在次氯酸,CCl3CHO 可能被氧化为 CCl3COOH,写出 CCl3CHO 被次氯酸氧化的化学反应方程式:。(4)、该设计流程存在一处缺陷导致副产物增多,请提出改进的措施: 。(5)、测定产品纯度:称取产品 0.36g 配成待测溶液,加入 0.1000mol·L-1碘标准溶液20.00mL,再加入适量 Na2CO3溶液,反应完全后加盐酸调节溶液的 pH,立即用0.0200mol·L-1 Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗溶液 20.00mL。则产品的纯度为 (计算结果保留三位有效数字)。( ; )18. 陶瓷工业中钴系色釉具有呈色稳定、呈色强度高等优点,利用含钴废料(主要成分为Co3O4 , 还含有少量的铝箔、LiCoO2等杂质)制备碳酸钴的工艺流程如下: (1)、“滤液①”主要成分是: ;“操作①”、“操作②”的分离方法是否相同 (填“是”或“否”)。(2)、“酸溶”中 H2O2的作用是: (选填“氧化剂”或“还原剂”或“既是氧化剂又是还原剂”);若用 Na2S2O3代替 H2O2则有两种硫酸盐生成,写出 Na2S2O3在“酸溶”时发生的化学方程式: 。(3)、已知钴、锂在有机磷萃取剂中的萃取率与 pH 的关系如下图所示,则有机磷萃取时最佳 pH 为 。
(1)、“滤液①”主要成分是: ;“操作①”、“操作②”的分离方法是否相同 (填“是”或“否”)。(2)、“酸溶”中 H2O2的作用是: (选填“氧化剂”或“还原剂”或“既是氧化剂又是还原剂”);若用 Na2S2O3代替 H2O2则有两种硫酸盐生成,写出 Na2S2O3在“酸溶”时发生的化学方程式: 。(3)、已知钴、锂在有机磷萃取剂中的萃取率与 pH 的关系如下图所示,则有机磷萃取时最佳 pH 为 。 (4)、Co2+萃取的反应原理如下:Co2+ + 2HR(有机层) CoR2 + 2H+ ,则从有机相中分离出 CoSO4需向有机溶剂中加入以下哪种试剂 ___________(填选项)。A、H2SO4 B、NaOH C、Co(OH)2 D、HR(5)、“沉钴”时 Na2CO3 的滴速过快或浓度太大,都会导致产品不纯,请分析原因: 。(6)、在空气中煅烧 CoCO3生成钴的氧化物和 CO2 , 测得充分煅烧后固体质量为 24.1g,CO2的体积为 6.72L(标准状况),则该钴氧化物的化学式为 。19. 氨气是基础有机合成工业和化肥工业的重要原料。(1)、诺贝尔奖获得者埃特尔提出了合成氨反应吸附解离的机理,通过实验测得合成氨势能如图所示:
(4)、Co2+萃取的反应原理如下:Co2+ + 2HR(有机层) CoR2 + 2H+ ,则从有机相中分离出 CoSO4需向有机溶剂中加入以下哪种试剂 ___________(填选项)。A、H2SO4 B、NaOH C、Co(OH)2 D、HR(5)、“沉钴”时 Na2CO3 的滴速过快或浓度太大,都会导致产品不纯,请分析原因: 。(6)、在空气中煅烧 CoCO3生成钴的氧化物和 CO2 , 测得充分煅烧后固体质量为 24.1g,CO2的体积为 6.72L(标准状况),则该钴氧化物的化学式为 。19. 氨气是基础有机合成工业和化肥工业的重要原料。(1)、诺贝尔奖获得者埃特尔提出了合成氨反应吸附解离的机理,通过实验测得合成氨势能如图所示:
在合成氨吸附解离的过程中,下列状态最稳定的是 (填选项)。
A. B.NH3(g) C.NH(ad)+2H(ad) D.N(ad)+3H(ad)
其中,NH3(ad) NH3(g) ∆H= kJ·mol-1 , 若要使该平衡正向移动,可采取的措施是(填选项)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
(2)、在上述实验条件下,向一密闭容器中通入 1molN2和 3molH2充分反应,达到平衡时放出 46kJ 热量,计算该条件下 H2的转化率 。(3)、在 t ℃、压强为 3.6 MPa 条件下,向一恒压密闭容器中通入氢氮比[c(H2):c(N2)] 为 3 的混合气体,体系中气体的含量与时间变化关系如图所示:
反应 20 min 达到平衡,试求 0~20 min 内氨气的平均反应速率 v(NH3)= MPa·min-1。若起始条件一样,在恒容容器中发生反应,则达到平衡时 H2的含量符合上图中 点(填“d”、“e”、“f”或“g”)。
(4)、在合成氨工艺中,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氮比[c(H2):c(N2)]为 3 时,平衡时氨气的含量关系式为:ω (NH3)=0.325·KP·P·(1-i ) 2 , (KP:平衡常数;P:平衡体系压强;i:惰性气体体积分数)。当温度为 500℃,不含惰性气体时,平衡体系压强为 2.4MPa,氨气的含量为 ω ,若此时增大压强,Kp 将(填“变大”、“变小”或“不变”)。若温度不变,体系中有 20%的惰性气体,欲使平衡时氨气的含量仍为 ω ,应将压强调整至 MPa。20. 铜是人类最早使用的金属之一,最近科学家发现 Cu 元素有很强的杀菌作用,还可代替Al 布线在硅芯片上。用黄铜矿(主要成分为 CuFeS2)生产粗铜,其反应原理如下: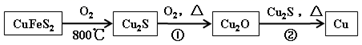
回答下列问题:
(1)、S 和 O 相比,第一电离能较小的元素是 ;在下列图示中,Si 的基态价电子排布图是(填选项字母)。A、
 B、
B、 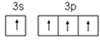 C、
C、  D、
D、 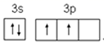 (2)、Cu2O 和 Cu2S 均为离子晶体,Cu2O 的熔点为 1235℃,Cu2S 的熔点为 1130℃,Cu2O熔点较高的原因是 。(3)、反应①、②中生成的气体 SO2中心原子的杂化方式为 , 分子的立体构型为 。(4)、与 NH3互为等电子体的粒子的化学式有 (写出一种)。工业上常用铜氨溶液制造人造丝,某学生做了如下实验:CuSO4溶液 蓝色沉淀 深蓝色溶液,蓝色沉淀溶于氨水的离子方程式为 。(5)、Cu2O 的晶胞结构如图所示,若原子坐标参数 A 为(0,0,0),B 为 ,则 C 原子的坐标参数为 。若该晶体的密度为 dg/cm3 , 阿伏加德罗常数的值为NA , 则该晶胞中 Cu 原子与 O 原子之间的距离为 pm。(用含 d 和 NA的式子表示)。
(2)、Cu2O 和 Cu2S 均为离子晶体,Cu2O 的熔点为 1235℃,Cu2S 的熔点为 1130℃,Cu2O熔点较高的原因是 。(3)、反应①、②中生成的气体 SO2中心原子的杂化方式为 , 分子的立体构型为 。(4)、与 NH3互为等电子体的粒子的化学式有 (写出一种)。工业上常用铜氨溶液制造人造丝,某学生做了如下实验:CuSO4溶液 蓝色沉淀 深蓝色溶液,蓝色沉淀溶于氨水的离子方程式为 。(5)、Cu2O 的晶胞结构如图所示,若原子坐标参数 A 为(0,0,0),B 为 ,则 C 原子的坐标参数为 。若该晶体的密度为 dg/cm3 , 阿伏加德罗常数的值为NA , 则该晶胞中 Cu 原子与 O 原子之间的距离为 pm。(用含 d 和 NA的式子表示)。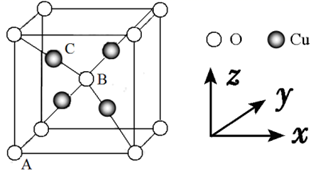 21. 化合物 J 具有镇痛作用,可以减轻病人的疼痛感,提高生活质量。其合成方法如下:
21. 化合物 J 具有镇痛作用,可以减轻病人的疼痛感,提高生活质量。其合成方法如下:
已知:
①R1COOR2+R3CH2COOR4
 +R2OH
+R2OH②
 (R1、R2、R3、R4为氢或烃基)
(R1、R2、R3、R4为氢或烃基)③ 苯胺(
 )与甲基吡啶互为芳香同分异构体 ,吡啶的结构简式(
)与甲基吡啶互为芳香同分异构体 ,吡啶的结构简式(  )(1)、A的名称为 , E 中含氧官能团的名称为 。(2)、A →B的反应类型为 。(3)、F 的结构简式为 。(4)、G→J的化学方程式为 。(5)、满足下列条件的 E 的六元环芳香同分异构体有 种。
)(1)、A的名称为 , E 中含氧官能团的名称为 。(2)、A →B的反应类型为 。(3)、F 的结构简式为 。(4)、G→J的化学方程式为 。(5)、满足下列条件的 E 的六元环芳香同分异构体有 种。a.环上有四个取代基,其中有三个相同且相邻的基团;
b.环上的一氯代物只有一种;
c.分子中含有一个甲基,不存在-NH-结构。
(6)、已知: (R、R’为烃基)。 是一种重要的化工中间体。以环己烯(
是一种重要的化工中间体。以环己烯(  )和乙醇为起始原料,结合已知信息选择必要的无机试剂,写出
)和乙醇为起始原料,结合已知信息选择必要的无机试剂,写出  的合成路线。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的合成路线。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。