广东省揭阳市2021年高考化学2月模拟试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 化学与环境密切相关。下列有关说法正确的是( )A、 小于7的大气降水是酸雨 B、 是城市空气质量报告的重点污染指标 C、煤的气化是物理变化,是实现煤的综合利用的途径之一 D、研发可降解的聚碳酸酯替代聚乙烯作为一次性塑料袋的生产原料,有利于遏制污染2. 设 为阿伏加德罗常数的数值。下列说法正确的是( )A、1 H2O2中含有共价键的数目为3 B、23gNa燃烧生成Na2O2失去的电子数为2 C、1L0.1 Na2SO3溶液中含有0.3 个氧原子 D、标准状况下,22.4LHCl溶于水后溶液中含有 个HCl分子3. 下列有关 溶液的叙述中,正确的是( )A、蒸干该溶液可以得到无水 固体 B、往该溶液中加入少量锌粉,可置换出铁单质 C、该溶液中, 、 、 、 可以大量共存 D、向该溶液中加入 溶液,反应的离子方程式为4. 海洋具有十分巨大的开发潜力。下列有关海水综合利用的说法正确的是( )A、海水晒盐的过程中只涉及化学变化 B、利用潮汐发电是将化学能转化为电能 C、将 转变为 是海水提溴中关键的化学反应 D、从海水制得的氯化钠除食用外,还可用于氯碱工业以制备金属钠5. 下列实验能达到预期目的的是( )A、通过 溶液以除去混在 中的少量 B、通过酸性 溶液以除去混在 中的少量乙烯 C、往 溶液中加入过量的氨水制备 D、将 溶液滴到一片土豆上,发现马上变蓝,说明土豆含有淀粉6. 下列说法正确的是( )A、 有两种同分异构体 B、淀粉、纤维素、蛋白质均属于天然高分子化合物 C、石蜡油受热分解的产物不能使酸性 溶液褪色 D、苯分子中含有3个碳碳双键,故1 苯最多与3 发生加成反应7. 生物净化法脱硫反应为 。下列说法正确的是( )A、该反应中 被还原 B、酸性强弱比较: C、当有34g 产生时,电子转移的物质的量为8 D、在高温条件下,脱硫反应进行的速率会更快、效果更好8. W、X、Y、Z是短周期元素。已知W单质是淡黄色固体,X单质是良好的半导体材料,Y原子最外层电子数是电子总数的2/3,Z是第三周期原子半径最小的金属元素。下列说法正确的是( )A、原子半径: B、气态氢化物的稳定性: C、电解Z的熔融氯化物可以制取Z单质 D、X和Z的最高价氧化物对应水化物均可溶于 溶液,故两者均是酸性氧化物9. 下列实验装置设计正确,且能达到目的的是( )
 A、实验I:配制一定物质的量浓度的稀硫酸 B、实验II:测定盐酸浓度 C、实验III:制取少量 D、实验IV:检验混合气体中的 和10. 用 代替 与燃料 反应是一种清洁的新型燃烧技术,发生如下反应:
A、实验I:配制一定物质的量浓度的稀硫酸 B、实验II:测定盐酸浓度 C、实验III:制取少量 D、实验IV:检验混合气体中的 和10. 用 代替 与燃料 反应是一种清洁的新型燃烧技术,发生如下反应:①
②
③
下列说法正确的是( )
A、①和②是主反应,反应③是副反应 B、反应③达到平衡后压缩容器体积,再次平衡时平衡常数增大 C、反应②达到平衡后充入适量 ,再次平衡时 的物质的量增大 D、 的反应热11. 下列实验操作、现象和结论均正确的是( )选项
实验操作
现象
结论
A
往 和水反应后得到的溶液中滴加几滴酚酞
溶液开始无明显变化,最后变成红色
和水反应有 生成
B
将浓硫酸滴到蔗糖表面
固体变黑膨胀,有刺激性气体产生
浓硫酸有脱水性和强氧化性
C
箔插入稀硝酸中
无明显现象
箔被钝化
D
将一小块 放入75%的酒精中
产生气泡
能置换出醇羟基中的氢
A、A B、B C、C D、D12. 下列叙述Ⅰ和Ⅱ均符合题意并有因果关系的是( )选项
叙述Ⅰ
叙述Ⅱ
A
锌的金属活动性比铁强
在海轮外壳上装锌块可减缓外壳腐蚀
B
汽油和植物油都属于烃
汽油和植物油都可以燃烧
C
铜绿的主要成分是碱式碳酸铜
铜绿在空气中受热分解能得到铜单质
D
有漂白性
能使酸性 溶液褪色
A、A B、B C、C D、D13. 是一种重要的杀菌消毒剂,其一种生产工艺如下:
下列说法正确的是( )
A、氧化性比较:稀 B、“电解”中阴极反应的主要产物是 和 C、“尾气吸收”用于除去少量 尾气。其中氧化剂与还原剂的物质的量之比为2∶3 D、利用含 和 的粗盐水制备“电解”用的食盐水,要加入的除杂试剂有 溶液、 溶液、盐酸14. 向20 0.20 溶液中加入少量 溶液,发生以下反应:i. ;ⅱ. 。 分解反应过程中能量变化和不同时刻测得生成 的体积(已折算成标准状况)如下:
0
5
10
20
…
0.0
8.96
15.68
22.40
…
下列判断正确的是( )
A、反应ⅰ是放热反应 B、反应ⅱ是整个反应的决速步骤 C、 是 分解反应的催化剂 D、0~20 的平均反应速率:15. 一种新型水锂充电电池采用复合膜包裹的金属锂和锰酸锂( )作电极材料,以 水溶液作电解质,工作时电池的总反应为 。下列有关该电池的说法错误的是( ) A、该电池放电时,溶液中的 向电极a移动 B、该电池的负极反应式为 C、电池充电时,阳极的锂元素质量分数减小 D、去掉包裹金属锂的复合膜能使金属锂的利用率更高16. 常温下,浓度均为1 、体积均为 的两种酸 和 ,分别加水稀释至体积V, 的变化曲线如图所示。下列叙述正确的是( )
A、该电池放电时,溶液中的 向电极a移动 B、该电池的负极反应式为 C、电池充电时,阳极的锂元素质量分数减小 D、去掉包裹金属锂的复合膜能使金属锂的利用率更高16. 常温下,浓度均为1 、体积均为 的两种酸 和 ,分别加水稀释至体积V, 的变化曲线如图所示。下列叙述正确的是( ) A、X点的 点的 B、 时, 溶液满足: C、相对Y点而言,X点的导电能力更强,X点水的电离程度更大 D、中和等体积1 的两种酸消耗等浓度的 溶液体积:
A、X点的 点的 B、 时, 溶液满足: C、相对Y点而言,X点的导电能力更强,X点水的电离程度更大 D、中和等体积1 的两种酸消耗等浓度的 溶液体积:二、非选择题
-
17. 己二酸(
 )是一种重要的化工原料和合成中间体。某实验小组以钨磷酸为催化剂, 开展绿色氧化合成己二酸的实验探究。 (1)、I.催化剂钨磷酸晶体( )的制备
)是一种重要的化工原料和合成中间体。某实验小组以钨磷酸为催化剂, 开展绿色氧化合成己二酸的实验探究。 (1)、I.催化剂钨磷酸晶体( )的制备实验流程如下:

乙醚的作用为 , 操作Ⅰ所需的玻璃仪器除烧杯外还有。
(2)、水层中的物质有大量 和少量 ,步骤①中发生反应的化学方程式是。(3)、II.己二酸的合成向三颈烧瓶中加入0.10g钨磷酸催化剂和30 30%双氧水,在室温下搅拌5 ,然后加入5.0 试剂X,在100℃左右回流反应3h,得到溶液A。
环己烯、环己醇、环己酮均可被双氧水氧化成己二酸。仅从所需双氧水理论用量的角度看,试剂X的最佳选择是_______(填序号)。
A、环己烯( )
B、环己醇(
)
B、环己醇(  )
C、环己酮(
)
C、环己酮(  )
(4)、在实际操作中,双氧水的实际用量通常要大于理论用量,原因是。(5)、如图是己二酸的浓度与温度关系曲线图。介稳区表示己二酸溶液处于饱和状态,稳定区表示己二酸溶液处于状态。实验室常根据直线EHI从溶液A获取己二酸晶体,对应的实验操作为 , 过滤。
)
(4)、在实际操作中,双氧水的实际用量通常要大于理论用量,原因是。(5)、如图是己二酸的浓度与温度关系曲线图。介稳区表示己二酸溶液处于饱和状态,稳定区表示己二酸溶液处于状态。实验室常根据直线EHI从溶液A获取己二酸晶体,对应的实验操作为 , 过滤。 (6)、III.己二酸的纯度测定
(6)、III.己二酸的纯度测定取0.2g己二酸晶体样品于锥形瓶中,加水溶解,滴加2滴酚酞试液,用 溶液滴定;平行滴定3次, 溶液的平均用量为V ,则己二酸纯度为。(己二酸化学式量为146)
18. 冶炼废水中砷元素主要以亚砷酸( )形式存在。可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
已知 与过量的 存在反应:
回答下列问题:
(1)、 中 元素的化合价是。(2)、“一级沉砷”中 的作用是。(3)、“一级沉砷”后剩余的部分 进入“二级沉砷”。加入 发生反应的化学方程式为①;②;③ 。(4)、滤渣A的成分除 、 外还有、。(5)、“二级沉砷”处理后的废水中 ,则该溶液中 约为多少? , (列式计算) 、 的 分别约为 、 。三、原理综合题
-
19. 乙苯催化脱氢生产苯乙烯的反应:

 (1)、t℃下,将1.00 乙苯加入体积为1L的密闭容器中,发生上述反应。反应时间与容器内气体总物质的量、总压强的数据如下表所示。
(1)、t℃下,将1.00 乙苯加入体积为1L的密闭容器中,发生上述反应。反应时间与容器内气体总物质的量、总压强的数据如下表所示。时间/
0
10
20
30
40
总物质的量/
1.00
n1
n2
n3
n4
总压强/100
1.00
1.25
1.35
1.40
1.40
①n4= , 平衡时乙苯的转化率为。
②列式计算t℃下该反应的平衡常数 。( 为以分压表示的平衡常数,计算结果保留1位小数)
(2)、实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气。测得温度和投料比M[ (乙苯)]对乙苯平衡转化率的影响如图所示。
①图中A、B、C三点对应平衡常数大小顺序为。
②图中投料比( 、 、 )的大小顺序为 , 理由是。
(3)、其他条件相同,在甲、乙两种催化剂的作用下,乙苯转化率与温度的关系如图所示。在甲催化剂的作用下,图中N点处(对应温度为320℃)乙苯的转化率 (填“可能是”“一定是”或“一定不是”)该温度下的平衡转化率。高于320℃时,乙苯的转化率降低的原因可能是。 20. 黄铜矿( )是炼铜的最主要矿物,在野外很容易被误认为黄金,故又称愚人金。(1)、基态 原子价层电子排布式为 , 其未成对电子数是。(2)、请判断沸点高低: (填写“>”或“<”)。 沸点低于 的原因是。(3)、S有多种价态的化合物。回答下列问题:
20. 黄铜矿( )是炼铜的最主要矿物,在野外很容易被误认为黄金,故又称愚人金。(1)、基态 原子价层电子排布式为 , 其未成对电子数是。(2)、请判断沸点高低: (填写“>”或“<”)。 沸点低于 的原因是。(3)、S有多种价态的化合物。回答下列问题:①下列关于气态 和 的说法中,正确的是。
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤对电子数目相等 D.都含有极性键
②将纯液态 冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图所示,此固态 中S原子的杂化轨道类型是。
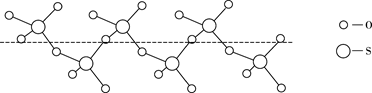
③ 、 中S的化合价均为+6.与 互为等电子体的分子的化学式为 , 中过氧键的数目为。
(4)、 的晶胞如图所示,晶胞参数为a 、b 。 的晶胞中每个 原子与个S原子相连,晶体密度 (列出计算式即可,阿伏加德罗常数的数值为 )。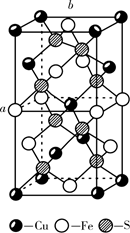 21. 有机玻璃具有透光性好、质轻的优点,可用于制造飞机风挡、舷窗等。实验室由链烃A制备有机玻璃的一种合成路线如下:
21. 有机玻璃具有透光性好、质轻的优点,可用于制造飞机风挡、舷窗等。实验室由链烃A制备有机玻璃的一种合成路线如下:
已知:核磁共振氢谱表明D只有一种化学环境的氢。
回答下列问题:
(1)、A的化学名称为。(2)、由A生成B的反应类型是 , 由B生成C的反应类型是。(3)、D的结构简式为 , 其分子中最多有个原子共平面。(4)、E生成F的化学方程式为。(5)、与E具有相同官能团的E的同分异构体有种。其中核磁共振氢谱为五组峰,且峰面积比为2∶2∶2∶1∶1的结构简式为。(6)、参照上述合成路线,设计一条由乙醇为起始原料制备 的合成路线
的合成路线