广东省惠州市2021年高考化学三模试卷
试卷更新日期:2021-04-07 类型:高考模拟
一、单选题
-
1. 陶瓷、背铜器、书画作品等都是中华文化的瑰宝,其中蕴藏丰富的化学知识。下列说法错误的是( )A、王羲之的《兰亭集序》保存完好的原因是墨的主要成分是碳,在常温下化学性质稳定 B、宋,王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜 C、商代后期铸造出工艺精湛的青铜器司母戊鼎,其材质属于合金 D、“素纱单衣”所用的蚕丝的主要成分是纤维素,属于天然高分子化合物2. 下列物质对应的组成正确的是( )A、小苏打: B、胆矾: C、熟石灰: D、干冰:3. 下列说法错误的是( )A、港珠澳大桥水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法 B、某天文望远镜的镜片材料为 ,属于新型无机非金属材料 C、用酒精和 杀菌消毒,都是利用其强氧化性 D、铅蓄电池、镍镉电池均属于二次电池,若不回收,则会污染环境4. 下列实验操作能达到实验目的的是( )
 A、用装置甲制取 B、用装置乙除去 中的少量 C、用装置丙收集 D、用装置丁从 溶液中获得无水5. 下列表述中,正确的是( )A、碳酸钠溶液呈碱性的原因: B、 溶液中滴加足量氢氧化钠溶液: C、用电子式表示 和 形成 的过程:
A、用装置甲制取 B、用装置乙除去 中的少量 C、用装置丙收集 D、用装置丁从 溶液中获得无水5. 下列表述中,正确的是( )A、碳酸钠溶液呈碱性的原因: B、 溶液中滴加足量氢氧化钠溶液: C、用电子式表示 和 形成 的过程: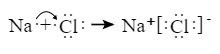 D、钢铁发生电化学腐蚀的正极反应:
6. 表述Ⅰ与表述Ⅱ中,两者无因果关系的是( )
D、钢铁发生电化学腐蚀的正极反应:
6. 表述Ⅰ与表述Ⅱ中,两者无因果关系的是( )选项
表述Ⅰ
表述Ⅱ
A
有强氧化性
用新制氯水杀菌,漂白
B
与 反应生成
用 作防毒面具供氧剂
C
具有还原性和导电性
可用作锌猛干电池的负极材料
D
在沸水中能形成胶体
用 溶液作为铜电路板刻蚀液
A、A B、B C、C D、D7. 工业上制备下列物质的生产流程不合理的是( )A、由黄铁矿制硫酸: B、由重晶石制可溶性钡盐:重晶石 C、由石英砂制高纯硅:石英砂 D、由铝土矿冶炼铝:铝土矿8. 在抗击新冠肺炎的过程中,科研人员研究了氯硝柳胺药物的疗效,它的结构简式如下。下列说法错误的是( ) A、该药物分子式为 B、该药物含有6种官能团 C、该药物能与氢氧化钠反应 D、该药物能发生加成反应9. 设 为阿伏加德罗常数的值。下列说法正确的是( )A、0.1mol苯中含有的碳碳双键数目为0.3 B、常温下, 含有的氧原子数为 C、 溶液中含有的 分子数为 D、标准状况下, 乙烯含有碳碳双键数为10. 下列各组离子在指定溶液中能大量共存的是( )A、常温下, 的溶液中: 、 、 、 B、加入 能放出 的溶液中: 、 、 、 C、常温下, 的溶液中: 、 、 、 D、常温下, 的溶液中: 、 、 、11. 高炉炼铁过程中发生的反应: ,已知该反应在不同温度下的平衡常数如下表,下列说法错误的是( )
A、该药物分子式为 B、该药物含有6种官能团 C、该药物能与氢氧化钠反应 D、该药物能发生加成反应9. 设 为阿伏加德罗常数的值。下列说法正确的是( )A、0.1mol苯中含有的碳碳双键数目为0.3 B、常温下, 含有的氧原子数为 C、 溶液中含有的 分子数为 D、标准状况下, 乙烯含有碳碳双键数为10. 下列各组离子在指定溶液中能大量共存的是( )A、常温下, 的溶液中: 、 、 、 B、加入 能放出 的溶液中: 、 、 、 C、常温下, 的溶液中: 、 、 、 D、常温下, 的溶液中: 、 、 、11. 高炉炼铁过程中发生的反应: ,已知该反应在不同温度下的平衡常数如下表,下列说法错误的是( )温度/℃
1000
1150
1300
平衡常数
4.0
3.7
3.5
A、 B、该反应的平衡常数表达式是 C、其他条件不变,向平衡体系充入 气体,K值减小 D、其他条件不变,升高温度时, 的平衡转化率降低12. 镁-空气电池是一种新型燃料电池,其工作原理如图所示。下列说法错误的是( ) A、金属Mg电极为负极,其电势低于空气电极的电势 B、电子流向:Mg电极→导线→空气电极→电解质溶液→Mg电极 C、电池总反应为2Mg+O2+2H2O=2Mg(OH)2 D、回收后的氢氧化镁经一系列转化,可重新制成镁锭循环利用13. 和 是环境污染性气体,可在 表面转化为无害气体,其总反应为 ,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法错误的是( )
A、金属Mg电极为负极,其电势低于空气电极的电势 B、电子流向:Mg电极→导线→空气电极→电解质溶液→Mg电极 C、电池总反应为2Mg+O2+2H2O=2Mg(OH)2 D、回收后的氢氧化镁经一系列转化,可重新制成镁锭循环利用13. 和 是环境污染性气体,可在 表面转化为无害气体,其总反应为 ,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法错误的是( ) A、 为氧化剂 B、 C、由图乙知该反应正反应的活化能小于逆反应的活化能 D、为了实现转化,需不断向反应器中补充 和14. 化合物A(如图所示)是一种常用的分析试剂,其中X、W、Z为同一短周期元素,W元素的L层有3个电子,Y元素的阴离子与 具有相同的核外电子层结构。下列叙述正确的是( )
A、 为氧化剂 B、 C、由图乙知该反应正反应的活化能小于逆反应的活化能 D、为了实现转化,需不断向反应器中补充 和14. 化合物A(如图所示)是一种常用的分析试剂,其中X、W、Z为同一短周期元素,W元素的L层有3个电子,Y元素的阴离子与 具有相同的核外电子层结构。下列叙述正确的是( ) A、气态氢化物的稳定性: B、 的 溶液, C、原子半径大小: D、X元素最高价氧化物对应的水化物能与它的氢化物反应15. 根据实验操作和现象,不能得出相应结论的是( )
A、气态氢化物的稳定性: B、 的 溶液, C、原子半径大小: D、X元素最高价氧化物对应的水化物能与它的氢化物反应15. 根据实验操作和现象,不能得出相应结论的是( )选项
实验操作和现象
结论
A
在常温下,等体积、 均为3的两种酸 和 ,分别与足量的 反应,酸 放出的氢气多
酸性:
B
试管中盛有 溶液,底部有少量铜,向其中加入稀硫酸,铜粉逐渐溶解
铜可与稀硫酸反应
C
淀粉溶液中加入少量稀硫酸,水浴加热5分钟,加氢氧化钠溶液至溶液呈碱性,再加入少量新制 ,继续加热几分钟,生成砖红色沉淀
淀粉已经水解
D
向 的 溶液中滴加 同浓度的 浴液后,再滴加 溶液,先产生白色沉淀,后出现黄色沉淀。
证明
A、A B、B C、C D、D16. 已知: ,室温下,向 的 溶液中滴加 的 溶液,溶液 随P的变化关系如图,下列说法正确的是( )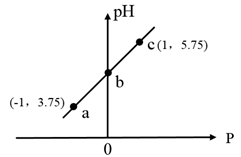 A、a点溶液中: B、b点坐标为 C、c点溶液中: D、溶液中水的电离程度:
A、a点溶液中: B、b点坐标为 C、c点溶液中: D、溶液中水的电离程度:二、非选择题
-
17. 草酸( )及其化合物广泛分布于动植物体中。
Ⅰ.某实验小组分别用水煮检验法和灼烧检验法对菠菜中的铁元素(主要以难溶的 形式存在)进行检测。实验如下:
a.水煮检验法:

b.灼烧检验法:
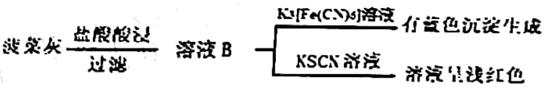 (1)、灼烧菠菜时应将其放在(填仪器名称)中加热。(2)、溶液A中未能检测出 的可能原因是;(3)、取溶液B,先滴加 溶液、再滴加 溶液。溶液呈红色;用离子方程式表示 的作用:。(4)、甲同学取少量溶液B,滴加酸性 溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有 。乙同学认为甲同学的实验方法不严谨,理由是。(5)、Ⅱ.利用草酸制备草酸亚铁晶体( )的流程及组分测定方法如下:
(1)、灼烧菠菜时应将其放在(填仪器名称)中加热。(2)、溶液A中未能检测出 的可能原因是;(3)、取溶液B,先滴加 溶液、再滴加 溶液。溶液呈红色;用离子方程式表示 的作用:。(4)、甲同学取少量溶液B,滴加酸性 溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有 。乙同学认为甲同学的实验方法不严谨,理由是。(5)、Ⅱ.利用草酸制备草酸亚铁晶体( )的流程及组分测定方法如下:
已知:几种物质的溶解度( )如下:
20℃
48
75
37
60℃
101
88
38
趁热过滤的原因是:。
(6)、氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M),称取ag草酸亚铁晶体置于锥形瓶中,用稀硫酸将其溶解,再用 的高锰酸钾标准液滴定,滴定时,眼睛应注视。到达滴定终点时,消耗高锰酸钾 ,则 。(已知: )18. 钼酸钠晶体( )是无公害型冷却水系统的金属级蚀剂,工业上利用钼精矿(主要成分是不溶于水的 ,含少量 等)制备钼酸钠的工艺如图所示。
回答下列问题:
(1)、① 中钼元素的化合价是;②在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是。
(2)、“焙烧”时 转化为 ,写出该反应的化学方程式:。(3)、“碱浸”所得 ,溶液中含 杂质,其中 , ,在结晶前需加入 固体以除去溶液中的 。当 开始沉淀时, 的去除率是。( ,溶液体积变化可忽略)(4)、“除杂”过程中加入的除杂剂是 ,则废渣的化学式为。(5)、钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在不同介质中的腐蚀速率实验结果如下图: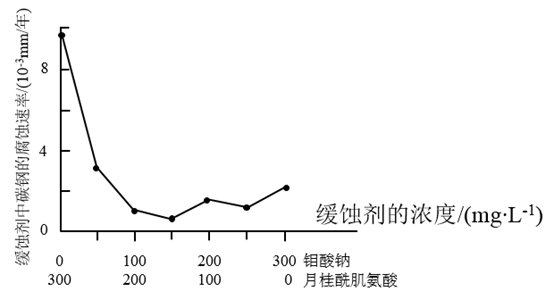
要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为。
(6)、另一种利用钼精矿制备钼酸钠的工艺流程中,直接向粉碎后的钼精矿中加入 溶液和 溶液来得到钼酸钠,则得到钼酸钠溶液的离子方程式为。19. 二氧化碳和氨的利用是我国能源领域的一个重要战略方向,目前我国科学家在以下方面已经取得重大成果。(1)、Ⅰ.①图1是由 制取C的太阳能工艺。已知过程1中 与 反应时 ,则 的化学式为。②过程1生成 的反应热为 ;过程2产生 的反应热为 。则制取C的反应 的 为。
 (2)、Ⅱ.以 和 为原料合成尿素的化学方程式为 。
(2)、Ⅱ.以 和 为原料合成尿素的化学方程式为 。合成的粗尿素中含有 杂质。通过控制温度和压强,可将 分解为 和 。研究温度和压强对 分解率的影响,结果如下:

若X代表压强,则温度: (填“>”或“<”)。
(3)、工业上含尿素的废水需经处理后才能排放。如图为一种电化学降解尿素的装置示意图,该过程中,尿素降解的产物之一为 :
写出尿素被降解的电极反应式:。
(4)、Ⅲ.在200℃时,向 带气压计的恒容密闭容器中通入 和 发生反应 ,测得初始压强为 ,反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示。
该反应过程中从 到 压强变小原因是。
(5)、 内,反应的平均反应速率 。(6)、用平衡分压代替平衡浓度表示的化学平衡常数 。[气体分压 气体总压 气体体积分数]20. 氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:(1)、化合物N2H4的电子式为。(2)、As原子的核外电子排布式为。(3)、P和S是同一周期的两种元素,P的第一电离能比S大,原因是。(4)、NH4+中H-N-H的健角比NH3中H-N-H的键角大,原因是。(5)、Na3AsO4中含有的化学键类型包括;AsO43-空间构型为 , As4O6的分子结构如图所示,则在该化合物中As的杂化方式是。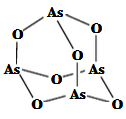 (6)、白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1 , 则该晶胞中含有的P原子的个数为 , 该晶体的密度为g·cm-3(用含NA、a的式子表示)。
(6)、白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1 , 则该晶胞中含有的P原子的个数为 , 该晶体的密度为g·cm-3(用含NA、a的式子表示)。 21. 化合物G是合成的一种减肥药的重要中间体,其合成路线如下:
21. 化合物G是合成的一种减肥药的重要中间体,其合成路线如下: (1)、A的化学名称为 , A和C中含氧官能团名称分别为和。(2)、 的反应类型为。(3)、F的分子式为 ,则F的结构简式为。(4)、由 的化学反应方程式为。(5)、写出满足下列条件的B的同分异构的结构简式。(写一种即可)
(1)、A的化学名称为 , A和C中含氧官能团名称分别为和。(2)、 的反应类型为。(3)、F的分子式为 ,则F的结构简式为。(4)、由 的化学反应方程式为。(5)、写出满足下列条件的B的同分异构的结构简式。(写一种即可)①能发生银镜反应
②能发生水解反应,水解产物与氯化铁溶液发生显色反应
③分子中只有3种不同化学环境的氢
(6)、完成以1, 丁二烯和 为原料制备
为原料制备  剩下的合成路线流程图。(无机试剂任用,合成路线流程图示例见本题题干)
剩下的合成路线流程图。(无机试剂任用,合成路线流程图示例见本题题干) 已知:①:

②: