江苏省苏州市吴江区2020年中考化学6月模拟试卷
试卷更新日期:2021-04-07 类型:中考模拟
一、单选题
-
1. 在我国全民抗击新冠疫情的战斗中,下列措施一定包含化学变化的是( )A、居家隔离 B、开窗通风 C、喷药消毒 D、佩戴口罩2. 2019 年 12 月以来,我国部分地区突发的新型冠状病毒肺炎威胁着人们的身体健康。为了方便检测体温,关于家中所备水银温度计说法正确的是( )
 A、水银的化学式是 Ag B、温度升高,是因为水银微粒变大了 C、水银温度计破碎之后属于有害垃圾 D、水银是一种混合物3. 下列与水相关的说法错误的是( )A、水在天然循环过程中发生了物理变化 B、活性炭在净水过程中发生了化学变化 C、生活中可用煮沸的方法降低水的硬度 D、明矾可促进浑浊水中悬浮物的沉降4. 下列物质由分子构成的是( )A、氨气 B、氯化钠 C、镁 D、金刚石5. 爱护水资源,下列哪一种是“国家节水标志”( )A、
A、水银的化学式是 Ag B、温度升高,是因为水银微粒变大了 C、水银温度计破碎之后属于有害垃圾 D、水银是一种混合物3. 下列与水相关的说法错误的是( )A、水在天然循环过程中发生了物理变化 B、活性炭在净水过程中发生了化学变化 C、生活中可用煮沸的方法降低水的硬度 D、明矾可促进浑浊水中悬浮物的沉降4. 下列物质由分子构成的是( )A、氨气 B、氯化钠 C、镁 D、金刚石5. 爱护水资源,下列哪一种是“国家节水标志”( )A、 B、
B、 C、
C、 D、
D、 6. 人体中含有50多种元素,某些元素缺乏后会对人体健康产生影响。下列说法错误的是( )A、缺锌会引起食欲不振,生长迟缓,发育不良 B、缺钙会使幼儿及青少年患佝偻病 C、缺碘会引起甲状腺疾病 D、缺铁会引起坏血病7. 空气是一种宝贵的自然资源。下列有关空气的说法错误的是()A、空气中的氧气主要来源于植物的光合作用 B、空气中氧气的质量分数约为21% C、氮气的化学性质不活泼,可用于食品的防腐 D、目前计入空气污染指数的有害气体主要包括SO2、CO、NO2以及臭氧等8. 下列分类正确的是( )A、小苏打、烧碱、醋酸——化合物 B、氯、碘、汞——非金属元素 C、塑料、合成橡胶、棉花——有机合成材料 D、金刚石、生铁、不锈钢——合金9. 下列实验操作正确的是( )A、点燃酒精灯
6. 人体中含有50多种元素,某些元素缺乏后会对人体健康产生影响。下列说法错误的是( )A、缺锌会引起食欲不振,生长迟缓,发育不良 B、缺钙会使幼儿及青少年患佝偻病 C、缺碘会引起甲状腺疾病 D、缺铁会引起坏血病7. 空气是一种宝贵的自然资源。下列有关空气的说法错误的是()A、空气中的氧气主要来源于植物的光合作用 B、空气中氧气的质量分数约为21% C、氮气的化学性质不活泼,可用于食品的防腐 D、目前计入空气污染指数的有害气体主要包括SO2、CO、NO2以及臭氧等8. 下列分类正确的是( )A、小苏打、烧碱、醋酸——化合物 B、氯、碘、汞——非金属元素 C、塑料、合成橡胶、棉花——有机合成材料 D、金刚石、生铁、不锈钢——合金9. 下列实验操作正确的是( )A、点燃酒精灯 B、稀释浓硫酸
B、稀释浓硫酸  C、检查装置气密性
C、检查装置气密性  D、取用液体药品
D、取用液体药品  10. 豆腐能为人体提供所需的多种氨基酸,其中含量最多的是亮氨酸,其化学式为 CxH13NO2 , 相对分子质量为 131,关于亮氨酸的说法正确的是( )A、亮氨酸是氧化物 B、亮氨酸化学式中的 x=6 C、亮氨酸由碳、氢、氮、氧四种原子构成的 D、亮氨酸中碳、氢、氮、氧四种元素的质量比为 6:13:1:211. 下列化学用语中对数字“3”的意义描述正确的是( )
10. 豆腐能为人体提供所需的多种氨基酸,其中含量最多的是亮氨酸,其化学式为 CxH13NO2 , 相对分子质量为 131,关于亮氨酸的说法正确的是( )A、亮氨酸是氧化物 B、亮氨酸化学式中的 x=6 C、亮氨酸由碳、氢、氮、氧四种原子构成的 D、亮氨酸中碳、氢、氮、氧四种元素的质量比为 6:13:1:211. 下列化学用语中对数字“3”的意义描述正确的是( )①Fe3+②3CO③ ④
 A、①表示元素的化合价 B、②表示分子的个数 C、③表示离子所带的电荷数 D、④表示原子核外电子数12. 有些化学实验操作的“先”与“后”,对化学实验结果或安全具有十分重要的意义.下列对实验操作“先”与“后”的设计中,正确的是( )A、制备气体前,先往装置中装入药品,后检查装置的气密性 B、做一氧化碳还原氧化铁的实验开始时,先加热,后通一氧化碳 C、加热高锰酸钾制取氧气的实验结束时,先将导管移出水面再熄灭酒精灯 D、做一氧化碳还原氧化铁的实验结束时,先停止通一氧化碳,后停止加热13. 关于金属及合金的说法错误的是( )A、合金中至少含有两种金属元素 B、生铁和钢是常见的铁合金 C、黄铜的硬度比纯铜的硬度大 D、焊锡的熔点比纯锡的熔点低14. 下列涉及的化学观点,其说法错误的是( )A、微粒观:春天百花盛开香气袭人,“香”是因为分子在不断运动 B、辩证观:氯化铵与草木灰均能促进植物生长,但二者混合施用会降低肥效 C、结构观:氢氧化钠与氢氧化钙溶液具有相似的化学性质,是因为其溶液中含有相同的OH﹣ D、变化观:自来水厂通过沉降过滤、杀菌等方法生产自来水,这些净水方法均属于化学变化15. 科学研究表明,氨气在常压下就可液化为液氨,液氨可用作汽车的清洁燃料,其燃烧时的主要反应为 .X的化学式为是( )A、N2 B、N C、NO D、N2O16. 如图表示某化学反应的微观过程,下列有关说法正确的是( )
A、①表示元素的化合价 B、②表示分子的个数 C、③表示离子所带的电荷数 D、④表示原子核外电子数12. 有些化学实验操作的“先”与“后”,对化学实验结果或安全具有十分重要的意义.下列对实验操作“先”与“后”的设计中,正确的是( )A、制备气体前,先往装置中装入药品,后检查装置的气密性 B、做一氧化碳还原氧化铁的实验开始时,先加热,后通一氧化碳 C、加热高锰酸钾制取氧气的实验结束时,先将导管移出水面再熄灭酒精灯 D、做一氧化碳还原氧化铁的实验结束时,先停止通一氧化碳,后停止加热13. 关于金属及合金的说法错误的是( )A、合金中至少含有两种金属元素 B、生铁和钢是常见的铁合金 C、黄铜的硬度比纯铜的硬度大 D、焊锡的熔点比纯锡的熔点低14. 下列涉及的化学观点,其说法错误的是( )A、微粒观:春天百花盛开香气袭人,“香”是因为分子在不断运动 B、辩证观:氯化铵与草木灰均能促进植物生长,但二者混合施用会降低肥效 C、结构观:氢氧化钠与氢氧化钙溶液具有相似的化学性质,是因为其溶液中含有相同的OH﹣ D、变化观:自来水厂通过沉降过滤、杀菌等方法生产自来水,这些净水方法均属于化学变化15. 科学研究表明,氨气在常压下就可液化为液氨,液氨可用作汽车的清洁燃料,其燃烧时的主要反应为 .X的化学式为是( )A、N2 B、N C、NO D、N2O16. 如图表示某化学反应的微观过程,下列有关说法正确的是( ) A、该反应属于化合反应 B、反应物甲的质量等于生成物丁的质量 C、甲和丙均为有机物 D、甲的化学式为C2H217. 能将盐酸、食盐水、澄清石灰水三种溶液一次性区分开来的试剂是( )A、Na2CO3 溶液 B、CaCl2 溶液 C、NaOH 溶液 D、酚酞溶液18. 下列各组离子能在pH=3的溶液中大量共存的是( )A、NH4+、Na+、NO3-、CO32- B、NO3-、Cu2+、SO42-、OH- C、Mg2+、K+、SO42-、Cl- D、Ca2+、Na+、HCO3-、Cl-19. 中考复习阶段,小红同学梳理了以下知识:①点燃一切可燃性气体之前一定要先检验其纯度②生成盐和水的反应一定是酸碱中和反应;③能使紫色石蕊溶液变蓝的一定是碱溶液;④合金、塑料、合成纤维都属于合成材料;⑤常见的干燥剂有烧碱、熟石灰和浓硫酸。以上叙述正确的有几个( )A、1个 B、2个 C、3个 D、4个20. 物质X与Ca(OH)2水溶液发生反应的化学方程式为:X+Ca(OH)2=Y+Cu(OH)2↓,下列说法正确的是( )A、X可能是酸 B、X和Y的相对分子质量之差为24 C、X可能是单质,也可能是化合物 D、Y只可能是CaCl221. 下列有关实验现象的描述正确的是( )A、向盛有鸡蛋清的试管中加入饱和的硫酸铵溶液,会析出沉淀 B、黄铜片和铜片相互刻画,铜片上留下的痕迹比黄铜片上的浅 C、将一氧化碳通入灼热的氧化铁,红棕色粉末逐渐变为银白色 D、向饱和氯化钠溶液中加入高锰酸钾固体,振荡,溶液不变色22. 除去下列物质中的杂质(括号内为杂质),所用试剂或方法错误的是( )
A、该反应属于化合反应 B、反应物甲的质量等于生成物丁的质量 C、甲和丙均为有机物 D、甲的化学式为C2H217. 能将盐酸、食盐水、澄清石灰水三种溶液一次性区分开来的试剂是( )A、Na2CO3 溶液 B、CaCl2 溶液 C、NaOH 溶液 D、酚酞溶液18. 下列各组离子能在pH=3的溶液中大量共存的是( )A、NH4+、Na+、NO3-、CO32- B、NO3-、Cu2+、SO42-、OH- C、Mg2+、K+、SO42-、Cl- D、Ca2+、Na+、HCO3-、Cl-19. 中考复习阶段,小红同学梳理了以下知识:①点燃一切可燃性气体之前一定要先检验其纯度②生成盐和水的反应一定是酸碱中和反应;③能使紫色石蕊溶液变蓝的一定是碱溶液;④合金、塑料、合成纤维都属于合成材料;⑤常见的干燥剂有烧碱、熟石灰和浓硫酸。以上叙述正确的有几个( )A、1个 B、2个 C、3个 D、4个20. 物质X与Ca(OH)2水溶液发生反应的化学方程式为:X+Ca(OH)2=Y+Cu(OH)2↓,下列说法正确的是( )A、X可能是酸 B、X和Y的相对分子质量之差为24 C、X可能是单质,也可能是化合物 D、Y只可能是CaCl221. 下列有关实验现象的描述正确的是( )A、向盛有鸡蛋清的试管中加入饱和的硫酸铵溶液,会析出沉淀 B、黄铜片和铜片相互刻画,铜片上留下的痕迹比黄铜片上的浅 C、将一氧化碳通入灼热的氧化铁,红棕色粉末逐渐变为银白色 D、向饱和氯化钠溶液中加入高锰酸钾固体,振荡,溶液不变色22. 除去下列物质中的杂质(括号内为杂质),所用试剂或方法错误的是( )选项
物质(杂质)
除杂质所用试剂或方法
A
FeSO4溶液(CuSO4溶液)
加入足量铁粉,过滤
B
NaOH溶液(Na2CO3溶液)
加入适量Ca(OH)2溶液,过滤
C
CO2气体(HCl气体)
依次通过碳酸钠溶液和浓硫酸
D
CuO粉末(C粉)
在空气中充分灼烧
A、A B、B C、C D、D23. 在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全中和的是( )A、滴入适量FeCl3溶液,溶液变黄,但无沉淀生成 B、滴入几滴酚酞试液,酚酞试液不变色 C、测得反应后溶液中Na+与Cl-的个数比为1:1 D、滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀24. 甲、乙、丙三种物质的转化关系如图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是( )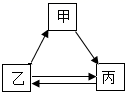
选项
甲
乙
丙
A
CaCl2
CaCO3
CO2
B
FeCl2
FeSO4
Fe
C
Na₂SO4
Na₂CO3
NaOH
D
CuO
O2
H2O
A、A B、B C、C D、D25. 已知:2CO2+2Na2O2=2Na2CO3+O2。在密闭容器中,将6.6gCO2与一定量的Na2O2固体充分反应后,气体变为3.8g。下列说法正确的是( )A、3.8g气体全部是O2 B、3.8g气体通过足量NaOH溶液后,气体减少2.2g C、反应后的固体是混合物 D、生成Na2CO3的质量为15.9g二、综合应用题
-
26. 化学与人类生活、生产息息相关。请回答下列问题:(1)、计算器使用的电池工作时,是将化学能主要转化为能。(2)、扑灭森林火灾的有效方法之一是将大火蔓延路线前的一片树木砍掉,形成隔离带,其灭火原理是。(3)、常用来改良酸性土壤的碱是。(4)、面粉是制作蛋糕的主要原料,面粉富含。(5)、用下列物质除去油污时,利用乳化作用的是(选填序号)。
A 汽油
B 洗洁精
C 氢氧化钠溶液
三、填空题
-
27. 完成下列变化的化学方程式,并按要求填空。(1)、赤铁矿炼铁 , 炼铁设备是。(2)、生石灰作为干燥剂的原理 , 该反应属于热反应(填“放”或“吸”)。(3)、氨水与硫酸反应 , 基本反应类型是反应。(4)、分别将铜片和锌片连接到电流表的正、负极,然后把锌片和铜片一起插入盛有硫酸铜溶液的烧杯中,发生的反应是。(5)、酒精(C2H6O)完全燃烧 , 酒精的某种水溶液中溶质和溶剂的氢原子个数相等,则该溶液中溶质的质量分数为。28. 如图为几种固体的溶解度曲线,回答下列问题:
 (1)、CuSO4的溶解度约为20g时,其对应的温度是℃;若想使该饱和溶液转化为不饱和溶液,可采取的方法是(写出一种即可)。(2)、80℃时,140g NaNO3溶于100g水形成的溶液是溶液(填“饱和”或“不饱和”)。80℃时,NaNO3的溶解度KNO3的溶解度(填“>”、“=”或“<”)。(3)、20℃时,NH4NO3溶液的溶质质量分数最大为(计算结果保留到0.1%)。(4)、若KNO3溶液中混有少量的NaCl杂质,可以采取方法获得较纯净的KNO3固体。
(1)、CuSO4的溶解度约为20g时,其对应的温度是℃;若想使该饱和溶液转化为不饱和溶液,可采取的方法是(写出一种即可)。(2)、80℃时,140g NaNO3溶于100g水形成的溶液是溶液(填“饱和”或“不饱和”)。80℃时,NaNO3的溶解度KNO3的溶解度(填“>”、“=”或“<”)。(3)、20℃时,NH4NO3溶液的溶质质量分数最大为(计算结果保留到0.1%)。(4)、若KNO3溶液中混有少量的NaCl杂质,可以采取方法获得较纯净的KNO3固体。四、实验题
-
29. 如图,请你回答下列问题:
 (1)、仪器①的名称是。(2)、实验室用装置B制取氧气,其反应的化学方程式是 , 若收集较干燥的氧气,应选择的收集装置是(填字母编号)。(3)、实验室用加热无水乙酸钠固体和氢氧化钠固体制取甲烷气体,在通常情况下甲烷是一种无色无味的气体,难溶于水,密度比空气小,现实验室制取并收集较纯净的甲烷应选用的装置是(填字母编号)。若用排水法收集,实验结束后先撤导气管后熄灭酒精灯,目的是。(4)、某同学以石灰石和稀盐酸为原料,在实验室中制备并收集一瓶干燥、纯净的二氧化碳气体,按照要求设计实验装置、连接仪器,并检验装置的气密性。
(1)、仪器①的名称是。(2)、实验室用装置B制取氧气,其反应的化学方程式是 , 若收集较干燥的氧气,应选择的收集装置是(填字母编号)。(3)、实验室用加热无水乙酸钠固体和氢氧化钠固体制取甲烷气体,在通常情况下甲烷是一种无色无味的气体,难溶于水,密度比空气小,现实验室制取并收集较纯净的甲烷应选用的装置是(填字母编号)。若用排水法收集,实验结束后先撤导气管后熄灭酒精灯,目的是。(4)、某同学以石灰石和稀盐酸为原料,在实验室中制备并收集一瓶干燥、纯净的二氧化碳气体,按照要求设计实验装置、连接仪器,并检验装置的气密性。①所选仪器的连接顺序为(写仪器序号字母)。
②制取二氧化碳所发生反应的化学方程式为。
③若将制得的二氧化碳通入足量的饱和澄清石灰水中,恰好完全反应时,所得溶液的质量将比之前溶液的质量(“变大”、“变小”或“不变”)。
五、科学探究题
-
30. 某化学兴趣小组在完成“常见金属的性质”实验时进行了以下一些探究活动。
[探究活动]:将铝丝插入硫酸铜溶液中未发现明显的实验现象。
(1)、[现象分析]:请分析出现上述实验现象的原因:。为顺利完成实验,你的建议是(2)、[继续实验]:兴趣小组同学根据你的建议,重新进行了实验,观察到了明显的实验现象。经充分反应后,该实验的现象是.(3)、经研究发现该反应的微观示意图如下图所示(图中微粒未完全画出)。则用实际参加反应的微粒符号来表示化学反应的式子是 (4)、兴趣小组在完成上述实验时,还发现了铝丝表面有少量气泡生成。根据已有知识和资料信息判断这种气体有可能是(资料信息:硫酸铜在水中会发生一些变化,生成微量的稀硫酸),反应的化学方程式是
(4)、兴趣小组在完成上述实验时,还发现了铝丝表面有少量气泡生成。根据已有知识和资料信息判断这种气体有可能是(资料信息:硫酸铜在水中会发生一些变化,生成微量的稀硫酸),反应的化学方程式是六、流程题
-
31. 钦和钛合金被认为是21世纪的重要金属材料。以铁铁矿(主要成分为FeTiO3 , 含有少量的Fe2O3、FeO等)为原料制TiO2 , 再由TiO2制金属Ti的工艺流程如图:

(查阅资料)钛、镁在高温下与空气中的氧气、二氧化碳等反应。
(1)、硫酸氧钛(TiOSO4)中Ti元素的化合价为 。(2)、写出工艺流程中生成硫酸铁的化学方程式: 。(3)、操作2的名称是 。(4)、工业上常在高温和氩气氛围中,用金属镁和TiCl4反应的方法制备Ti,氢气的作用是 。(5)、TiO2可与焦炭、氯气在高温下反应,该反应中氯气和碳的质量按71:12的比例参加反应,反应的化学方程式为 。32. 盐酸是一种重要的酸。(1)、工业上制备盐酸的基础原料是精制食盐。粗盐(含有可溶性杂质主要有MgSO4、CaCl2)精制过程如图:
①加入Ba(OH)2溶液可以同时除去两种杂质离子,写出反应的化学方程式:。
②检验所加Na2CO3溶液过量的方法是。
③向溶液X中加入适量盐酸的目的是。
(2)、利用中和反应可以测定盐酸的浓度。将40g 0.8%氢氧化钠溶液逐滴加入到20g盐酸中,边滴加边搅拌。随着氢氧化钠溶液的滴加,溶液pH变化如图所示。所用盐酸的溶质质量分数为多少。(写出计算过程)
-
-
-