华师大版科学九年级上暑期预习练习卷(10)(常见的盐)
试卷更新日期:2016-09-20 类型:复习试卷
一、选择题
-
1. 碳酸钠是重要的化工原料,其俗称为( )A、纯碱 B、苛性钠 C、食盐 D、消石灰2. 以下是四位同学对生活中的现象进行探究后的结果的表述,其中不正确的是( )A、“纯碱”其实不是碱,属于盐类 B、可用纯碱代替洗涤灵洗涤餐具表面的油污 C、用纯碱可除去面团发酵产生的酸 D、用加水溶解的方法检验纯碱中是否混入了食盐3.
小红欲探究鸡蛋壳的主要成分,她设计了如图所示的( )
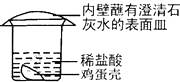 A、鸡蛋壳表面有气泡产生 B、此实验能证明鸡蛋壳的主要成分是碳酸钙 C、表面皿内壁有白色物质出现 D、此实验中涉及反应都遵守质量守恒定律4.
A、鸡蛋壳表面有气泡产生 B、此实验能证明鸡蛋壳的主要成分是碳酸钙 C、表面皿内壁有白色物质出现 D、此实验中涉及反应都遵守质量守恒定律4.如图所示,试管中盛有某种液体,将气球中的某种固体小心的倒入试管中,不能观察到气球变大的一组物质是( )
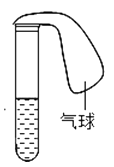 A、氯化钠和水 B、铁粉和稀硫酸 C、生石灰和水 D、二氧化锰和过氧化氢溶液5. 下列物质中既能跟盐酸反应又能跟氢氧化钙溶液反应的是( )A、硝酸铵 B、氧化铜 C、纯碱 D、食盐6. 下列各组物质能在同一无色溶液中大量共存的是( )A、NaOH,NaCl、HCl B、H2SO4、KCl、FeCl3 C、BaCl2、KNO3、NaCl D、AgNO3、ZnCl2、NaNO37. 滴有酚酞的Ba(OH)2溶液分别与下列各物质恰好完全反应后,溶液仍显红色的是( )
A、氯化钠和水 B、铁粉和稀硫酸 C、生石灰和水 D、二氧化锰和过氧化氢溶液5. 下列物质中既能跟盐酸反应又能跟氢氧化钙溶液反应的是( )A、硝酸铵 B、氧化铜 C、纯碱 D、食盐6. 下列各组物质能在同一无色溶液中大量共存的是( )A、NaOH,NaCl、HCl B、H2SO4、KCl、FeCl3 C、BaCl2、KNO3、NaCl D、AgNO3、ZnCl2、NaNO37. 滴有酚酞的Ba(OH)2溶液分别与下列各物质恰好完全反应后,溶液仍显红色的是( )
A、CO2 B、H2SO4溶液 C、CuSO4溶液 D、Na2CO3溶液8. 类推是化学学习中常用的思维方法.下列类推结果不正确的是( )A、CaCO3与稀盐酸反应生成CO2 , Na2CO3也能与稀硫酸反应生成CO2 B、点燃H2和O2的混合气体可能爆炸,则点燃CH4和O2的混合气体也可能爆炸 C、CO能与Fe2O3反应生成Fe,CO也能与CuO反应生成Cu D、NaOH能使无色酚酞试液变红色,Cu(OH)2也能使无色酚酞试液变红色9. 物质甲长期敞口放置会变质。下列说法正确的是( )A、甲一定是氢氧化钠 B、甲变质一定是与氧气发生了反应 C、甲变质后质量一定会减小 D、甲变质一定是由化学反应引起的10.如图所示,瓶中X为固体,当把滴管内的液体Y滴入瓶中,导管口一定没有气泡产生的是( )
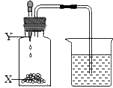
A
B
C
D
X
MnO2
CaO
NaHCO3
NH4NO3
Y
H2O2
H2O
HCl
H2O
A、A B、B C、C D、D二、填空题
-
11. 选择H、C、Cl、O、Na、Ca六种元素中的适当元素,组成符合下列要求的物质,将化学式填在空格中:(1)、常用做调味品的一种盐是;(2)、广泛应用于肥皂、石油、造纸、纺织和印染工业的一种碱;
(3)、用于改良酸性土壤;12. 下表是几种家用清洁剂的功能、有效成分。清洁剂名称
洁厕灵
活氧彩漂
漂白精
功能
有效清除污垢,除异味
漂洗衣物,使色彩更鲜艳
快速漂除衣物污渍
有效成分
HCl
H2O2
NaClO
据表回答下列问题:
(1)、“洁厕灵”不能用于大理石清洁的理由是(用化学方程式表示)。(2)、“洁厕灵”与“漂白精’不能混用。二者若混合易产生一种有毒气体,反应的化学方程式为:NaClO+2HCl=NaCl+X十+H2O,则X的化学式为。13. 工业用盐亚硝酸钠是一种有咸味、易溶于水的白色固体,有毒.水溶液呈碱性,亚硝酸钠能将Fe2+转化为Fe3+ . 请回答以下问题:(1)、亚硝酸钠(NaNO2)所属类别是;(2)、下列方法中,能用来区别NaNO2与NaCl固体的是________;A、观察颜色 B、品尝味道 C、用水溶解 D、测试两溶液pH值14. Na2CO3、CaCO3、BaCO3等统称为碳酸盐,碳酸盐均能与稀盐酸反应生成二氧化碳,回答下列问题: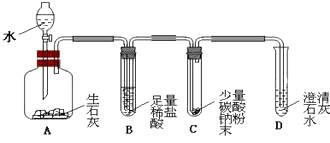 (1)、仿写一种碳酸盐的化学式;(2)、如图所示实验中,将A装置中分液漏斗的活塞打开,使适量水流入广口瓶中,B中观察到的现象是 , D中观察到的现象是。15. CaCO3、CaO、Ca(OH)2等物质间的转化关系可用下图表示。
(1)、仿写一种碳酸盐的化学式;(2)、如图所示实验中,将A装置中分液漏斗的活塞打开,使适量水流入广口瓶中,B中观察到的现象是 , D中观察到的现象是。15. CaCO3、CaO、Ca(OH)2等物质间的转化关系可用下图表示。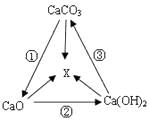 (1)、请写出Ca(OH)2的一种用途:。(2)、若图中的X是CaCl2 , 请结合图示写出一个有X生成的反应的化学方程式。(3)、为检验生石灰中含有未烧透的石灰石:取样,加入稀盐酸,观察到固体逐渐溶解, , 证明样品中含有石灰石。16. 下图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。
(1)、请写出Ca(OH)2的一种用途:。(2)、若图中的X是CaCl2 , 请结合图示写出一个有X生成的反应的化学方程式。(3)、为检验生石灰中含有未烧透的石灰石:取样,加入稀盐酸,观察到固体逐渐溶解, , 证明样品中含有石灰石。16. 下图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。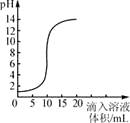 (1)、氢氧化钠和盐酸恰好完全反应时,溶液的pH7(填“大于”、“小于”或“等于”)。(2)、根据曲线,该反应是将滴入中。(3)、当滴入溶液的体积为5 mL时,所得溶液中的溶质为(写化学式),若在此溶液中滴入石蕊溶液,溶液显色。17.
(1)、氢氧化钠和盐酸恰好完全反应时,溶液的pH7(填“大于”、“小于”或“等于”)。(2)、根据曲线,该反应是将滴入中。(3)、当滴入溶液的体积为5 mL时,所得溶液中的溶质为(写化学式),若在此溶液中滴入石蕊溶液,溶液显色。17.为了检验某石材中是否含有碳酸根,进行了如下实验(装置见图);先在锥形瓶中加入石材样品碎块,再加入一定量的稀盐酸,观察实验现象,得出结论.试回答以下问题:
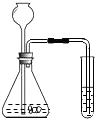 (1)、试管中应加入的物质是;(2)、如果观察到锥形瓶中有产生,试管中出现的现象,证明该石材中含有碳酸根;(3)、若含碳酸根的物质是碳酸钙,请写出锥形瓶中所发生的化学方程式18.
(1)、试管中应加入的物质是;(2)、如果观察到锥形瓶中有产生,试管中出现的现象,证明该石材中含有碳酸根;(3)、若含碳酸根的物质是碳酸钙,请写出锥形瓶中所发生的化学方程式18.某混合溶液可能含Na2SO4、Na2CO3、NaCl、NaNO3中的一种或几种溶质,为验证其组成,实验如下:
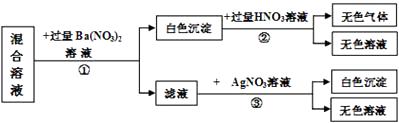 (1)、混合溶液的溶质中一定没有。(2)、第②步的反应方程式。(3)、只改变上述三步骤中所用三种试剂的滴加顺序,也可得到同样的验证结论,则这三种试剂滴加的顺序依次为(填写化学式)。
(1)、混合溶液的溶质中一定没有。(2)、第②步的反应方程式。(3)、只改变上述三步骤中所用三种试剂的滴加顺序,也可得到同样的验证结论,则这三种试剂滴加的顺序依次为(填写化学式)。三、实验探究题
-
19. 碳酸氢钠(NaHCO3)俗称“小苏打”,在生活中用途广泛.某化学实验小组的同学对碳酸氢钠的性质进行探究。(1)、【探究实验1】碳酸氢钠溶液的酸碱性
用试管取适量碳酸氢钠溶液,滴加酚酞试液,振荡,溶液变浅红色。
结论:。
(2)、【探究实验2】能与酸反应取适量碳酸氢钠加入试管中,滴加稀盐酸,再把燃着的木条迅速伸入试管,木条熄灭,碳酸氢钠和盐酸的化学反应方程式:。
(3)、【探究实验3】能与碱反应
查阅资料:NaHCO3+NaOH═Na2CO3+H2O;氢氧化钙微溶于水.用试管取适量碳酸氢钠溶液,滴加氢氧化钠溶液,无明显现象.(提示:可以选择CaCl2溶液做试剂,通过证明有Na2CO3生成,从而证明二者发生了反应)如图,两位同学分别进行了甲、乙两个实验。回答下列问题:
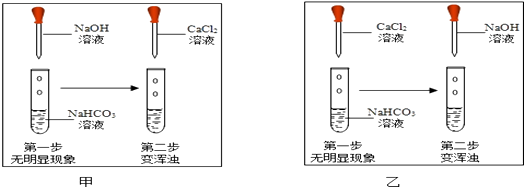
比较甲、乙两个实验的目的性区别是;
有同学提出两个实验都不足以证明有Na2CO3生成,其理由是;要证明有Na2CO3生成,还需要进行的操作是。
20. 假期,小亮同学在家中与妈妈做面包,发现妈妈揉面粉时在面粉中加入一种白色粉末,做出的面包疏松多孔,口感很好。他很感兴趣,想探究这种“神奇粉末”的成分。【查阅资料】通过对市场上相关产品进行调查,小亮发现了如下图所示的三种商品:
 (1)、【设计实验】鲍创探究这种白色粉末的成分。
(1)、【设计实验】鲍创探究这种白色粉末的成分。取少量白色粉末于试管中,加入适量蒸馏水,发现白色粉末溶解,无其他明显现象,实验结论是;另取少量白色粉末于试管中,加入 , 有无色气体产生,鲍创认为白色粉末是纯碱。
(2)、【实验反思】徐哲同学认为小亮同学根据上面的实验现象,不能得出白色粉末是纯碱,你若认为徐哲说法有道理,请用化学方程式解释不能得出结沦的原因。为了得到鉴别纯碱和小苏打的正确方法,小亮继续查找资料,发现它们有下列的性质:性质
碳酸钠
碳酸氢钠
溶解性
20℃时溶解度21.6g,溶解时放热
20℃时溶解度9.8g,溶解时放热
加热
不分解
发生分解反应,分解产物为碳酸钠、二氧化碳和水.
根据上面信息,检验白色粉末的方法之一是:20℃时,在100克水中加入12克该白色粉末,充分溶解后,如果有白色固体剩余,则为。
(3)、在查找资料过程中,小亮同学还发现纯碱不是碱,是由于其水溶液显碱性而得名。现要验证纯碱溶液是否显碱性,请写出用pH试纸来测其pH值的操作过程。四、解答题
-
21. 工业上煅烧石灰石制取生石灰,建筑业上利用生石灰与水反应制得熟石灰用以抹墙,熟石灰吸收空气的二氧化碳气体后变成坚硬的石灰墙,这些过程中涉及到的化学方程式表示依次为:
①;
②;
③。
22. 煅烧含碳酸钙80%的石灰石100t,生成二氧化碳多少吨?若石灰石中的杂质全部进入生石灰中,可得这样的生石灰多少吨?
23. 某化学兴趣小组欲检验当地石灰石中碳酸钙的纯度。在实验室将25g石灰石样品(杂质不参与反应,也不溶于水)放入盛有100g稀盐酸的烧杯中恰好完全反应。测得烧杯中物质总质量为116.2g。求:(1)、生成二氧化碳的质量为;(2)、稀盐酸溶液中溶质的质量分数。24. 对化肥的销售,国家规定了明确的质量要求。某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量的水,样品完全溶解后,与足量氢氧化钡溶液充分反应。产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如图所示。(假定杂质不参加反应)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?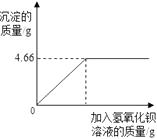
XX牌钾肥
主要成分:K2SO4(K2SO4含量≥86%)
净重:50Kg
XX化工有限公司