华师大版科学九年级上暑期预习练习卷(9)(重要的碱)
试卷更新日期:2016-09-20 类型:复习试卷
一、选择题
-
1.
通过实验我们测得了食盐溶液、石灰水、盐酸、食醋的pH,请你在下图中判断表示盐酸pH的点是( )
 A、A点 B、B点 C、C点 D、D点2. 小烧杯中盛有含石蕊的氢氧化钠溶液,向其中逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是( )A、紫色—红色—蓝色 B、蓝色—紫色—红色 C、蓝色—红色—紫色 D、紫色—蓝色—红色3. 判断一种化合物是否属于碱类的根本依据是( )
A、A点 B、B点 C、C点 D、D点2. 小烧杯中盛有含石蕊的氢氧化钠溶液,向其中逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是( )A、紫色—红色—蓝色 B、蓝色—紫色—红色 C、蓝色—红色—紫色 D、紫色—蓝色—红色3. 判断一种化合物是否属于碱类的根本依据是( )
A、能否与酸反应生成盐和水 B、溶于水后看能否使无色酚酞试液变红 C、电离时生成的阴离子是否全部是OH- D、电离时是否有OH-生成4. 鉴别下列各组物质,选用的试剂(括号内的物质)正确的是( )A、氢氧化钠溶液和澄清石灰水(稀盐酸) B、碳酸钠溶液和氯化钠溶液(澄清石灰水) C、氯化钠溶液和稀盐酸 (氢氧化钠溶液) D、稀盐酸和稀硫酸(锌粒)5. 下列溶液的pH最小的是( )
A、10%KOH B、20%KOH C、10%HCl D、20%HCl6. 下图有四种实验设计及操作,实验过程中其现象不足以说明CO2与NaOH溶液发生了反应的是( )
A、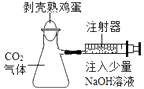 B、
B、 C、
C、 D、
D、 7. 下列实验方案中,合理的是( )
7. 下列实验方案中,合理的是( )
A、分离木炭粉和CuO:在空气中充分灼烧 B、验证质量守恒定律:比较镁条燃烧前后固体质量 C、制备Fe(OH)3:向FeCl3溶液中加入NaOH溶液,过滤、洗涤、干燥 D、除去CO2中的HCl和水蒸气:依次通过过量的NaOH溶液、浓硫酸8. 为了除去物质中的杂质(括号内为杂质),需要选用适当的试剂,其中正确的是( )A、C(Zn)﹣稀硫酸 B、CaCl2溶液(HCl)﹣Ba(OH)2溶液 C、CO2(CO)﹣澄清的石灰水 D、NaOH溶液[Ca(OH)2]﹣K2CO3溶液9. 滴有酚酞的石灰水与足量的下列物质充分反应,酚酞仍显红色的是( )A、稀硫酸 B、盐酸 C、硫酸铜溶液 D、碳酸钾溶液10. 向含有稀盐酸和氯化铜的混合溶液中滴加NaOH溶液,如图曲线中描述正确的是( )A、 B、
B、 C、
C、 D、
D、
二、填空题
-
11. 请对以下方案及现象做出合理补充或解释:(1)、不能服用NaOH治疗胃酸过多,原因是NaOH具有性;(2)、将铜丝浸入AgNO3溶液中的现象:。12. 在氢氧化钾溶液中滴入几滴无色酚酞,溶液呈 色;然后滴加稀盐酸至恰好完全反应时,溶液的pH 7(填“大于”、“小于”或“等于”);该反应的化学方程式为 。
13. 氢氧化钠固体必须密封保存的原因有两个方面:(1)、物理方面的原因是;(2)、化学方面的原因是(用化学方程式表示)。14.敞口放置的氢氧化钠溶液易变质,请写出此过程的化学方程式:。现向一定质量且部分变质的氢氧化钠溶液中滴加入稀盐酸,并振荡。(如下图)表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况。那么,图线BC段对应的实验现象是 , 在C点时溶液中的溶质是。
 15. 中和反应在日常生活和工农业生产中有广泛应用,如:(1)、农业上可用来降低土壤的酸性,改良土壤结构的物质是;(2)、医疗上可用含氢氧化镁的药物来中和过多的胃酸(视为盐酸),有关反应的化学方程式为;(3)、取某硫酸厂排出的一定体积的废水与一定量的氢氧化钠溶液混合后,溶液恰好呈中性。若改用与该氢氧化钠溶液的质量和溶质质量分数均相同的氢氧化钾溶液与上述一定体积的废水混合,则所得溶液的pH7(填“>”、“<”或“=”)。16. 在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图。
15. 中和反应在日常生活和工农业生产中有广泛应用,如:(1)、农业上可用来降低土壤的酸性,改良土壤结构的物质是;(2)、医疗上可用含氢氧化镁的药物来中和过多的胃酸(视为盐酸),有关反应的化学方程式为;(3)、取某硫酸厂排出的一定体积的废水与一定量的氢氧化钠溶液混合后,溶液恰好呈中性。若改用与该氢氧化钠溶液的质量和溶质质量分数均相同的氢氧化钾溶液与上述一定体积的废水混合,则所得溶液的pH7(填“>”、“<”或“=”)。16. 在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图。 (1)、该反应的化学方程式为:。(2)、要得到此变化曲线,所进行的操作是(填序号)。
(1)、该反应的化学方程式为:。(2)、要得到此变化曲线,所进行的操作是(填序号)。①将稀盐酸滴加到氢氧化钠溶液中 ②将氢氧化钠溶液滴加到稀盐酸中
(3)、当加入溶液的质量为ag时,所得溶液中的溶质为(写化学式)。(4)、当加入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液呈色。17.下图表示初中常见几种不同物质之间的关系,图中“……”表示虚线两边的物质可以转化或相互反应,A,B,C,D的相对分子质量依次增大。请根据以下每个问题的具体情况分别进行回答。
 (1)、若A能依次转化为D,A为标准状态下密度最小的气体,D的相对分子质量为100。则A的化学式为 , C的化学式为。(2)、若从A到D,相邻物质间可以互相反应,且A,B,C,D为四种不同类别的物质,C固体在空气中易潮解且溶于水会放热,则A与B反应的化学方程式为 , 判断B和C是否恰好完全反应,加入的试剂是。(3)、若D能依次转化为A,D由三种元素组成,原子个数比为1:2:2,则B的化学式为 , D→C的化学反应方程式为。18. 某化学兴趣小组的同学在学完《酸和碱的中和反应》后,集体创作了一个小魔术:“变色玫瑰”——用滤纸编制的白玫瑰喷洒无色液体乙后变红,继续喷洒该液体后又变为白色。组员揭密:喷洒无色液体乙前,白玫瑰先用某无色液体甲处理过;喷洒的无色液体乙是由两种液体混合而成的;组成甲、乙两种液体的物质都是初中化学常见的物质。(1)、液体乙可能是。(2)、液体甲中的溶剂是。(3)、玫瑰花由红色变为白色时发生反应的化学方程式可能是。
(1)、若A能依次转化为D,A为标准状态下密度最小的气体,D的相对分子质量为100。则A的化学式为 , C的化学式为。(2)、若从A到D,相邻物质间可以互相反应,且A,B,C,D为四种不同类别的物质,C固体在空气中易潮解且溶于水会放热,则A与B反应的化学方程式为 , 判断B和C是否恰好完全反应,加入的试剂是。(3)、若D能依次转化为A,D由三种元素组成,原子个数比为1:2:2,则B的化学式为 , D→C的化学反应方程式为。18. 某化学兴趣小组的同学在学完《酸和碱的中和反应》后,集体创作了一个小魔术:“变色玫瑰”——用滤纸编制的白玫瑰喷洒无色液体乙后变红,继续喷洒该液体后又变为白色。组员揭密:喷洒无色液体乙前,白玫瑰先用某无色液体甲处理过;喷洒的无色液体乙是由两种液体混合而成的;组成甲、乙两种液体的物质都是初中化学常见的物质。(1)、液体乙可能是。(2)、液体甲中的溶剂是。(3)、玫瑰花由红色变为白色时发生反应的化学方程式可能是。三、实验探究题
-
19. 假日里,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:(1)、对白色粉末成分的猜想和成因分析:
白色粉末的成分
形成的原因
可能是
石灰水与空气中CO2反应生成的沉淀
可能是
暑假气温较高,溶质的溶解度降低或溶剂蒸发,
石灰水中的溶质析出
经过反复思考,同学们认为白色粉末还可能是它们的混合物。
(2)、设计实验:甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解,于是他得出粉末中一定有CaCO3的结论.乙同学查阅了溶解性表(如下图),认为甲同学的结论不严密,理由是:。OH-
Cl-
CO
NO
Ca2+
微
溶
不
溶
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
实验步骤
可能观察到的现象
结论
取上述试管中的上层清液,
滴加1~2滴无色酚酞试液
不变色
往上述试管内残留的固体中加入稀盐酸
白色粉末中有CaCO3
由上述实验可知白色粉末的成分是:。
20. 某研究性学习小组在实验中发现:不仅碱溶液可以使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红.碱溶液可以使酚酞试液变红,是因为碱在水中解离出了OH- , 那么Na2CO3溶液中究竟是哪种粒子可以使酚酞试液变红呢?他们设计了如图三个实验,请你和他们一起探究并完成下列问题: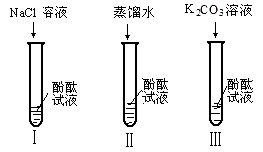
(1)、实验Ⅰ是为了;(2)、实验Ⅱ加入蒸馏水的目的是探究水分子是否能使酚酞试液变红,小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是;(3)、实验Ⅲ滴入Na2CO3溶液,振荡,酚酞试液变红,向变红后的溶液中再逐滴滴入过量的CaCl2溶液,红色逐渐消失,同时还观察到生成 , 反应的化学方程式:;由实验Ⅰ、Ⅱ、Ⅲ得出结论:CO32-可以使酚酞试液变红;(4)、小组同学在与老师交流上述结论时,老师说:“其实Na2CO3溶液能使酚酞试液变红也是由于溶液中存在OH-”。你认为Na2CO3溶液中存在OH-的原因是:。四、解答题
-
21. 盛装氢氧化钠的试剂瓶必须密封,否则会变质,其原因是:(用文字解释);在上述溶液加入氯化钙溶液有白色的沉淀生成,反应的化学方程式是。

