备考2018年高考化学一轮基础复习:专题10 卤素及其化合物
试卷更新日期:2017-11-24 类型:一轮复习
一、单选题
-
1. 化学与社会、生产、生活密切相关,下列说法正确的是( )A、澳大利亚学者研究发现,夏季给鸡喂食碳酸水会使蛋壳变厚 B、陶瓷、水泥及所有玻璃都是硅酸盐产品 C、绿色化学的核心是应用化学原理对环境污染进行治理 D、Cl2有漂白性,所以用Cl2可与石灰乳反应制备含氯消毒剂2.
在玻璃中加入溴化银(AgBr)和氧化铜可制得变色镜片,其中所含物质及变色原理如图所示,下列说法不正确的是( )
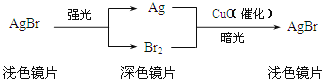 A、溴化银应避光保存 B、变色镜片可反复变色 C、变色镜片颜色变深的过程发生了化合反应 D、变色镜片中的氧化铜在变色过程中质量不变3. 近年来,加“碘”食盐中较少使用碘化钾,因其口感苦涩且在贮藏和运输中易变化,目前代之加入是( )A、I2 B、KIO C、NaIO D、KIO34. 某同学用下列装置制备并检验Cl2的性质.下列说法正确的是( )A、
A、溴化银应避光保存 B、变色镜片可反复变色 C、变色镜片颜色变深的过程发生了化合反应 D、变色镜片中的氧化铜在变色过程中质量不变3. 近年来,加“碘”食盐中较少使用碘化钾,因其口感苦涩且在贮藏和运输中易变化,目前代之加入是( )A、I2 B、KIO C、NaIO D、KIO34. 某同学用下列装置制备并检验Cl2的性质.下列说法正确的是( )A、 图中:如果MnO2过量,浓盐酸就可全部消耗
B、
图中:如果MnO2过量,浓盐酸就可全部消耗
B、 图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照,量筒内最后剩余气体为HCl和氧气
C、
图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照,量筒内最后剩余气体为HCl和氧气
C、 图中:生成蓝色的烟
D、
图中:生成蓝色的烟
D、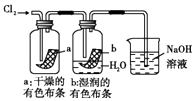 图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
5. 下列反应能说明卤素的活泼性顺序的是( )
图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
5. 下列反应能说明卤素的活泼性顺序的是( )①2HClO4+Br2(g)═2HBrO4+Cl2
②2NaBr+Cl2═NaCl+Br2
③2KI+Cl2═2KCl+I2④2KI+Br2═2KBr+I2 .
A、①②③ B、①②④ C、②③④ D、①②③④6. 下列关于F、Cl、Br、I性质的比较,不正确的是( )A、单质的颜色随核电荷数的增加而加深 B、单质的熔、沸点随核电荷数的增加而升高 C、单质的氧化性减弱 D、它们的氢化物的稳定性随核电荷数的增加而增强7. 下列叙述正确的是( )A、Fe分别与氯气和稀盐酸反应所得氯化物相同 B、常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 C、氯气具有漂白性 D、根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO8. 下列物质能使品红溶液褪色,且褪色原理基本相同的是( )①活性炭
②新制氯水
③二氧化硫
④臭氧掌
⑤过氧化钠
⑥双氧水.
A、①②④ B、②③⑤ C、②④⑤⑥ D、③④⑥9. 向KBr和KI的混合溶液中通入足量的氯气后,溶液蒸干后并将剩余物灼烧,最后残余的物质是( )A、KCl B、KCl和I2 C、KCl和Br2 D、KCl和KBr10. 饱和氯水久置后,溶液中的各种粒子:①Cl2②H2O ③Cl﹣④HClO ⑤H+减少的是( )A、①③④ B、①②③ C、①②④ D、②④二、填空题
-
11. 漂白粉的主要成分是;有效成分是;漂白原理是(用方程式表示) .12. 新制备的氯水,显色,说明氯水中有分子存在。向氯水中滴入几滴AgNO3溶液,立即有生成,说明氯水中有存在。蓝色石蕊试纸遇到氯水后,首先变红,但很快又褪色,这是因为。氯水经光照后,颜色逐渐消失,并放出无色 , 该反应的化学方程式为。13. A、B、C、D四个集气瓶中分别充满了Cl2、O2、H2、HCl四种气体中的一种。A瓶中的气体是黄绿色;C和A中的气体混合见光会爆炸;将D瓶的瓶盖打开,在潮湿空气中会出现白雾。根据以上现象判断各瓶中的气体分别是:
A.;B.;C.;D.。
14. 某同学按如图进行实验,在A中放的是干燥的红色布条,在B中放的是湿润的红色布条,在C中盛放的是氢氧化钠溶液,回答下列问题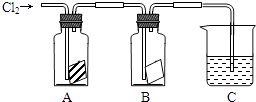
A中现象是 B中现象是
结论是
③若C中盛有的是混有酚酞溶液的氢氧化钠溶液,当通入一定量的氯气时溶液红色褪去,有同学说红色消失的原因有两种可能,请你帮他写出哪两种可能?
a:
b:
请设计实验证明哪种可能正确 .
三、综合题
-
15. 海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.(1)、在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl
②Cl+H2→HCl+H
③H+Cl2→HCl+Cl
…
反应②中形成的化合物的电子式为;反应③中被破坏的化学键属于键(填“极性”或“非极性”).
(2)、已知在短周期主族元素中,元素a与氯元素相邻且属同一周期,元素b也与氯元素相邻且属于同一主族,那么比较元素a、b以及氯元素三者的原子半径由大到小的顺序是(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第周期族.(3)、卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法错误的是 (填字母).A、卤素单质的熔沸点按F2、Cl、Br2、I2的顺序由低到高 B、原子半径按 C、Cl、Br、I的顺序由大到小 D、卤化氢的稳定性按的H E、HCl、HBr、HI的顺序由强到弱 F、卤素单质与氢气化合按的F2、Cl2、Br2、I2顺序由难变易(4)、碘单质及其化合物具有重要应用.下列说法正确的是(填字母).a. I与 I互为同位素
b.加碘食盐能使淀粉溶液变蓝
c.从海带中提取I2的过程只发生化学变化
d.提纯含泥沙的粗碘可用升华法.
16. 食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的.已知:氧化性:IO3﹣>Fe3+>I2还原性:S2O32﹣>I﹣
反应式:3I2+6OH﹣═5I﹣+IO3﹣+3H2O,KI+I2⇌KI3
(1)、某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+).用适量蒸馏水溶解,并加稀硫酸酸化,将所得溶液分3份:第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO3固体后,滴加淀粉试剂,溶液不变色.①该红色物质是(用化学式表示);CCl4中显示紫红色的物质是(用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为;
(2)、KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境中KI与氧气反应的化学方程式: .将I2溶于KI溶液,在低温条件下,可制得KI3・H2O.该物质作为食盐加碘剂是否合适?
(填“是”或“否”),并说明理由: .
(3)、为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .A、Na2S2O3 B、AlCl3 C、Na2CO3 D、NaNO2(4)、对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+: .17. 如图所示的装置中,A是氯气发生仪器,C、D 为气体净化装置(C中装有饱和食盐水,D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液.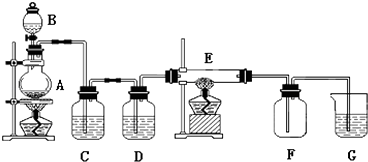
请回答下列问题:
(1)、仪器A的名称是;(2)、实验室制氯气的化学方程式:MnO2+4HCl(浓);(3)、C装置的作用是;D装置的作用是;(4)、E中发生化学反应的方程式为:;(5)、烧杯G中发生反应的化学方程式为: .18. 为验证氯气的性质,某小组用如图所示的微型实验装置进行试验,a、b、c、d、e、是浸有相关溶液的滤纸.小组同学用KMnO4晶体与浓盐酸反应来制取少量的氯气,向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.其化学方程式为:KMnO4+HCl(浓)→KCl+Cl2↑+MnCl2+H2O (未配平),请回答下列问题: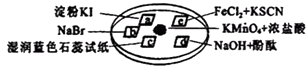 (1)、上述反应中,元素的化合价升高;而 元素被还原.(2)、配平上述反应:
(1)、上述反应中,元素的化合价升高;而 元素被还原.(2)、配平上述反应:KMnO4+ HCl(浓)═ KCl+ Cl2↑+ MnCl2+ H2O
(3)、c处湿润蓝色石蕊试纸会先后 , 产生此现象的原因是: .(4)、e处滤纸的实验现象是: , 写出氯气与Fe2+反应的离子方程式是: .(5)、上述反应若在标准状况下产生56L的氯气,则转移电子为 .