备考2018年高考化学一轮基础复习:专题9 铜及其化合物
试卷更新日期:2017-11-24 类型:一轮复习
一、单选题
-
1. 取一定质量的铜片和一定体积的浓硫酸放在烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,若要使铜片继续溶解可向烧瓶中加入( )A、稀H2SO4 B、稀盐酸 C、K2SO4固体 D、KNO3固体2. 铁屑和铜屑一起放入稀HNO3中,有少量铜屑剩余,则溶液中可能有的金属离子是( )A、Fe3+和Cu2+ B、Fe2+和Cu2+ C、Fe2+和Fe3+ D、只有Fe2+3. CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( )
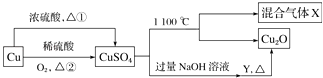 A、相对于途径②,途径①更好地体现了绿色化学思想 B、X可能是SO2和SO3的混合气体 C、Y可以是葡萄糖溶液 D、将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体4. 向铁和铜的混合物中加入一定量的稀硫酸,反应后剩余了m1克金属,再继续加入一定量的硝酸钠溶液后剩余了m2克金属,则m1和 m2的大小关系正确的是( )A、m1=m2 B、m1>m2 C、m1<m2 D、m1≥m25. 铜与过量的浓硝酸反应,当有0.2mol硝酸被还原时,参加反应的铜为( )A、0.05mol B、0.1mol C、0.2mol D、0.04mol6. 某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是( )
A、相对于途径②,途径①更好地体现了绿色化学思想 B、X可能是SO2和SO3的混合气体 C、Y可以是葡萄糖溶液 D、将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体4. 向铁和铜的混合物中加入一定量的稀硫酸,反应后剩余了m1克金属,再继续加入一定量的硝酸钠溶液后剩余了m2克金属,则m1和 m2的大小关系正确的是( )A、m1=m2 B、m1>m2 C、m1<m2 D、m1≥m25. 铜与过量的浓硝酸反应,当有0.2mol硝酸被还原时,参加反应的铜为( )A、0.05mol B、0.1mol C、0.2mol D、0.04mol6. 某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是( ) A、实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2 B、实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强 C、实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O D、由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应7. 下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
A、实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2 B、实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强 C、实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O D、由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应7. 下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )序号
X
Y
Z
W
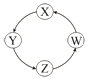
①
Cu
CuSO4
Cu(OH)2
CuO
②
Na
NaOH
Na2CO3
NaCl
③
Cl2
Ca(ClO)2
HClO
HCl
④
Fe
FeCl3
FeCl2
Fe(OH)2
A、①②③ B、①③④ C、②③ D、①④二、填空题
-
8. 在浓硝酸中放入铜片:
①开始反应的化学方程式为 .
②若铜有剩余,则反应将要结束时的反应的离子方程是:
③待反应停止后,再加入少量的25%的稀硫酸,这时铜片上又有气泡产生,其原因是 .
9. 初中实验用碳还原氧化铜来制备金属铜,要求温度较高,普通酒精灯很难达到该温度.某实验小组用无水硫酸铜代替氧化铜,只需用普通酒精灯加热反应,能达到相同的实验目的.将生成的混合气体通入以下装置进行检验,试回答下列问题: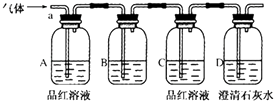 (1)、A中的品红溶液褪色,证明有气体;C中品红溶液无明显现象,D中的澄清石灰水变浑浊,证明有气体;(2)、B中可加入 , 以除去混合气体中的某种气体;
(1)、A中的品红溶液褪色,证明有气体;C中品红溶液无明显现象,D中的澄清石灰水变浑浊,证明有气体;(2)、B中可加入 , 以除去混合气体中的某种气体;a、酸性高锰酸钾溶液 b、饱和碳酸氢钠溶液
c、饱和氯化钠溶液 d、溴水
(3)、依据上述实验现象,请写出碳还原硫酸铜的化学方程式 .10. 如图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题: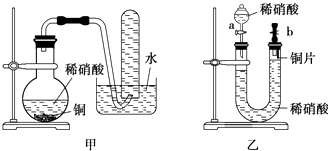 (1)、写出铜和稀硝酸反应的离子方程式: .(2)、实验装置甲能否证明铜和稀硝酸反应的产物是NO气体(填“能”或“不能”),请简述理由(用文字和化学方程式表示):(3)、若用实验装置乙进行实验,检查装置气密性的操作是
(1)、写出铜和稀硝酸反应的离子方程式: .(2)、实验装置甲能否证明铜和稀硝酸反应的产物是NO气体(填“能”或“不能”),请简述理由(用文字和化学方程式表示):(3)、若用实验装置乙进行实验,检查装置气密性的操作是三、实验探究题
-
11. 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.
该小组同学利用如图装置进行实验.
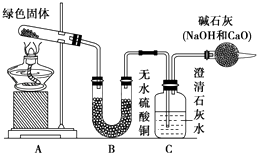
①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊.
②取少量加热后生成的黑色固体于试管中,加入稀硫酸.观察到黑色固体逐渐溶解,溶液变成蓝色.
③取少量上述蓝色溶液加入试管中,浸入一根洁净的铁丝.观察到铁丝表面有红色物质析出.
请回答下列问题:
(1)、绿色固体中含有的元素是 .(2)、加热后试管中剩余的黑色物质是 .(3)、假设该绿色物质是一种纯净物,则其化学式可能是 , 加热分解的化学方程式为 .(4)、上述实验步骤③中的反应的离子方程式为 .(5)、实验装置最后的干燥管的作用是 .(6)、如果将B、C两装置对调,能否达到实验目的? , 为什么? .12.研究铜及其化合物的性质对科研、生产生活有重要的意义.
(1)铜可采用如下方法制备
①火法炼铜:Cu2S+O2
 2Cu+SO2
2Cu+SO2②湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被 (填“氧化”或“还原”)成铜单质,若用①法每制得32gCu,转移电子的物质的量是 .
(2)在潮湿的空气中铜可以发生电化学腐蚀,生成铜绿,铜绿的化学式为 发生腐蚀的正极反应式为 ,由铜和锌组成的黄铜合金不易生锈,其防腐蚀的方法是 .
(3)①Li﹣﹣CuO电池总反应为:2Li+CuO═Li2O+Cu.电解质溶液为高氯酸锂有机溶液,电池的正极反应式为 .
②Cu2O是一种半导体材料,可在碱性溶液中用电解法制取,电解总反应式为:
2Cu+H2O
 Cu2O+H2↑,阳极反应式为 ;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式 .
Cu2O+H2↑,阳极反应式为 ;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式 .(4)为了回收粗铜精炼后阳极泥中的Ag和Au,某实验小组查阅了有关资料如下表:
编号
常温下反应
化学平衡常数
反应甲
Au+6HNO3⇌Au(NO3)3+3NO2↑+3H2O
<10﹣5
反应乙
Au3++4Cl﹣⇌[AuCl4]﹣
>105
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸体积比为l:3的混合物).请你运用化学平衡移动原理,简要说明金能溶于王水的原因 .
13. 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:[铜矿石] [铜精矿石] [冰铜] [粗铜] [电解铜]
(1)、在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物.①该过程中两个主要反应的化学方程式分别是、;
②反射炉内生成炉渣的主要成分是 .
(2)、冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化为Cu2O.生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜.该过程发生反应的化学方程式分别是、 .(3)、粗铜的电解精炼如图所示.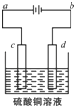
①在粗铜的电解过程中,粗铜板应是图中电极(填图中的字母);
②在电极d上发生的电极反应式为;
③若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 .