江苏省南京市秦淮区2015-2016学年九年级化学第一次模拟考试试卷
试卷更新日期:2017-11-20 类型:中考模拟
一、选择题
-
1. 下列过程中,只发生物理变化的是( )A、滴水成冰 B、酿酒成醋 C、伐薪烧炭 D、百炼成钢2. 下列物质中,属于天然有机高分子材料的是( )A、酒精 B、尼龙 C、棉花 D、石墨3. 下列有关粗盐初步提纯的实验操作中,正确的是( )A、
 B、
B、 C、
C、 D、
D、 4. 下列粒子结构示意图中,表示阴离子的是( )A、
4. 下列粒子结构示意图中,表示阴离子的是( )A、 B、
B、 C、
C、 D、
D、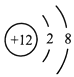 5. 下列说法正确的是( )A、化学家拉瓦锡利用红磷和氧气的反应研究了空气的成分 B、在稀释浓硫酸时,一定要把水沿器壁慢慢注入浓硫酸中 C、向滴有红墨水的水中投入几块木炭,振荡后液体红色变浅 D、将紫色的鲜花插入白醋的稀溶液中,几天后鲜花变为蓝色6. 有X、Y、Z三种金属,把足量X放入Y(NO3)2和Z(NO3)2的混合溶液中,充分反应后过滤,滤渣中只有X、Z。据此判断这三种金属的活动性由强到弱的顺序为( )A、Y>X>Z B、Y>Z>X C、X>Y>Z D、X>Z>Y7. 下列各组离子在水中一定能大量共存,并形成无色透明溶液的是( )A、Na+、Fe3+、NO3-、OH- B、H+、K+、NO3-、HCO3- C、K+、Ba2+、MnO4-、SO42- D、H+、NH4+、Cl-、SO42-8. 尿素[CO(NH2) 2]是蛋白质代谢的产物。下列关于尿素的说法中不正确的是( )A、尿素是一种氮肥 B、尿素由1个碳原子、1个氧原子、2个氮原子和4个氢原子构成 C、尿素中碳、氧两种元素的质量比为3︰4 D、尿素中氮元素的质量分数为46.7%9. 甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图。下列说法中正确的是( )
5. 下列说法正确的是( )A、化学家拉瓦锡利用红磷和氧气的反应研究了空气的成分 B、在稀释浓硫酸时,一定要把水沿器壁慢慢注入浓硫酸中 C、向滴有红墨水的水中投入几块木炭,振荡后液体红色变浅 D、将紫色的鲜花插入白醋的稀溶液中,几天后鲜花变为蓝色6. 有X、Y、Z三种金属,把足量X放入Y(NO3)2和Z(NO3)2的混合溶液中,充分反应后过滤,滤渣中只有X、Z。据此判断这三种金属的活动性由强到弱的顺序为( )A、Y>X>Z B、Y>Z>X C、X>Y>Z D、X>Z>Y7. 下列各组离子在水中一定能大量共存,并形成无色透明溶液的是( )A、Na+、Fe3+、NO3-、OH- B、H+、K+、NO3-、HCO3- C、K+、Ba2+、MnO4-、SO42- D、H+、NH4+、Cl-、SO42-8. 尿素[CO(NH2) 2]是蛋白质代谢的产物。下列关于尿素的说法中不正确的是( )A、尿素是一种氮肥 B、尿素由1个碳原子、1个氧原子、2个氮原子和4个氢原子构成 C、尿素中碳、氧两种元素的质量比为3︰4 D、尿素中氮元素的质量分数为46.7%9. 甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图。下列说法中正确的是( ) A、甲的溶解度比乙大 B、t1℃时,将等质量的乙、丙分别配成饱和溶液,所得溶液质量:乙>丙 C、将甲、丙的饱和溶液分别由t1℃升温到t2℃,两种溶液中溶质的质量分数相等 D、将t3℃时甲、乙、丙的饱和溶液分别恒温蒸发等量的水,析出溶质的质量:甲>乙>丙10. 在A+3B = 2C+2D的反应中,14gA完全反应生成44gC和18gD,若A的相对分子质量为28,则B的相对分子质量是( )A、16 B、32 C、64 D、9611. 微晶锆陶瓷可以应用于指纹传感器。在元素周期表中锆元素的某些信息如图所示,下列有关锆的说法正确的是( )
A、甲的溶解度比乙大 B、t1℃时,将等质量的乙、丙分别配成饱和溶液,所得溶液质量:乙>丙 C、将甲、丙的饱和溶液分别由t1℃升温到t2℃,两种溶液中溶质的质量分数相等 D、将t3℃时甲、乙、丙的饱和溶液分别恒温蒸发等量的水,析出溶质的质量:甲>乙>丙10. 在A+3B = 2C+2D的反应中,14gA完全反应生成44gC和18gD,若A的相对分子质量为28,则B的相对分子质量是( )A、16 B、32 C、64 D、9611. 微晶锆陶瓷可以应用于指纹传感器。在元素周期表中锆元素的某些信息如图所示,下列有关锆的说法正确的是( )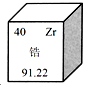 A、属于非金属元素 B、原子序数为40 C、相对原子质量是91.22g D、原子核内中子数为4012. 下图所示的情况中,铁钉最容易生锈的是( )A、
A、属于非金属元素 B、原子序数为40 C、相对原子质量是91.22g D、原子核内中子数为4012. 下图所示的情况中,铁钉最容易生锈的是( )A、 B、
B、 C、
C、 D、
D、 13. 下列对有关知识的归纳不完全正确的一组是( )
13. 下列对有关知识的归纳不完全正确的一组是( )A
保鲜的原理
B
灭火的原理
干冰——降温
生石灰——防潮
氮气——防腐
油锅着火时用锅盖盖灭——隔绝空气
住宅失火时用水浇灭——降低着火点
扑灭森林火灾时设置隔离带——隔离可燃物
C
常见物质的区分方法
D
常见合金的主要性能
硬水和软水——加肥皂水
生石灰和熟石灰——加水
氯化铵和磷矿粉——观察颜色
不锈钢——抗腐蚀性能好
焊锡——熔点低
硬铝——强度和硬度好
A、A B、B C、C D、D14. 实验室中有一瓶久置的氢氧化钠溶液,以下实验设计合理的是( )序号
实验目的
实验操作
①
证明溶液发生变质
取少量溶液,加入足量稀盐酸
②
确定溶液中溶质的成分
取少量溶液,加入适量氢氧化钡溶液,过滤,向滤液中滴加酚酞溶液
③
测定溶液中碳酸钠的质量分数
取一定质量溶液,加入足量稀盐酸,将生成的气体通入浓硫酸,测浓硫酸的增重
④
除去溶液中的碳酸钠
向溶液中滴加氢氧化钡溶液至恰好完全反应,过滤
A、①② B、②③ C、①④ D、②④15. (A类学校选做A类题,B类学校选做B类题,C类学校选做C类题。) (1)、(A类)常温下,下列各组物质中,甲既能与乙反应又能与丙反应的是( )
(1)、(A类)常温下,下列各组物质中,甲既能与乙反应又能与丙反应的是( )甲
乙
丙
A
Fe2O3
CO
稀盐酸
B
H2
Cl2
CuO
C
Ba(NO3)2溶液
稀硫酸
NaOH溶液
D
CO2
Ca(OH)2溶液
H2O
A、A B、B C、C D、D(2)、(B类)常温下,下列各组物质中,甲乙之间、乙丙之间可以相互转化的是( )甲
乙
丙
A
CO
CO2
CaCO3
B
H2O2
O2
SO2
C
Fe3O4
Fe
FeSO4
D
H2CO3
H2O
Ca(OH)2
A、A B、B C、C D、D(3)、(C类)下列各组物质中,存在如图所示的相互反应和一步转化关系的是( )甲 乙 丙 A H2SO4 CO2 Ca(OH)2 B HCl MgCl2 Cu C CaO CaCO3 Ca(OH) 2 D SO3 H2O NaOH A、A B、B C、C D、D二、填空题
-
16. 根据下列实验装置图,回答有关问题:
 (1)、写出装置图中标号仪器的名称:① , ②。(2)、实验室制取二氧化碳的化学方程式为 , 选用的收集装置为(填字母),检验二氧化碳是否收集满的方法是。(3)、实验室常用锌粒和稀硫酸反应制取氢气,选用的发生装置为(填字母)。
(1)、写出装置图中标号仪器的名称:① , ②。(2)、实验室制取二氧化碳的化学方程式为 , 选用的收集装置为(填字母),检验二氧化碳是否收集满的方法是。(3)、实验室常用锌粒和稀硫酸反应制取氢气,选用的发生装置为(填字母)。点燃氢气前,一定要。
(4)、查阅资料发现,氧化铜也可用作过氧化氢分解制氧气的催化剂,该反应的化学方程式为。若选用F作为氧气的发生装置,铜丝的螺旋处预先要在酒精灯上加热一段时间,目的是。17. 只有当两种化合物互相交换成分,生成物中有或有气体或有水生成时,复分解反应才可以发生。仿照示例填表:反应物(I)
反应物(Ⅱ)
发生复分解反应的化学方程式(各举一例)
示例
酸
碱
HCl+NaOH = NaCl+H2O
A
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
B
碱
盐
C
氧化物
酸
D
CuSO4+BaCl2 = BaSO4↓+CuCl2
18. 黄铜矿经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4 , 利用以下实验可制取补血剂原料碳酸亚铁并回收铜。 (1)、步骤Ⅰ中,发生反应的化学方程式包括:
(1)、步骤Ⅰ中,发生反应的化学方程式包括:①Fe2(SO4)3+Fe = 3FeSO4 ,
② ,
③。
(2)、步骤Ⅱ中加入一种试剂可实现其转化,该试剂可以是(填化学式)。(3)、步骤Ⅲ回收铜的实验操作包括:①过滤、②洗涤、③加足量稀硫酸、④干燥,正确的操作排序是(填序号)。(4)、若废铁屑含有少量铁锈,对实验结果(填“有”或“无”)影响。19. 图中A~H是初中化学常见的物质。B是最常用的溶剂;D、E、F、H是四种不同类别的物质,且均含有地壳中含量第三的元素;四个虚线圈中的反应各属于四个不同的基本反应类型。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。 (1)、写出化学式:B , H。(2)、写出化学方程式:C与E的反应。(3)、G→F是反应(填基本反应类型),G中一定含有元素(填元素名称)。20. 某化学兴趣小组进行以下实验:
(1)、写出化学式:B , H。(2)、写出化学方程式:C与E的反应。(3)、G→F是反应(填基本反应类型),G中一定含有元素(填元素名称)。20. 某化学兴趣小组进行以下实验:
【提出问题】实验一和实验二中,现象为何不同?
【查阅资料】氢氧化钠溶液和硫酸铜溶液反应会生成蓝色的氢氧化铜,但当硫酸铜溶液过量时,也会生成浅绿色的碱式硫酸铜。
(1)、【分析讨论】下列说法正确的是 (填字母)。
A、加热实验一反应后生成的物质,出现黑色固体 B、实验二中生成了碱式硫酸铜 C、根据实验一和实验二可知,反应物相同时,反应物的量不同,产物可能不同 D、根据实验一和实验二可知,反应物相同时,反应条件不同,产物可能不同(2)、【继续探究】该小组同学对碱式硫酸铜产生了兴趣,通过以下实验探究碱式硫酸铜受热分解的产物。(已知:无水硫酸铜遇H2O变蓝;SO2能使酸性高锰酸钾溶液褪色。)
装置
操作及现象
分解产物
A
试管中出现黑色固体,将黑色固体溶于稀硫酸,溶液呈蓝色
B
U形管中出现蓝色固体
C
溶液颜色
SO2
D
O2
(3)、【拓展延伸】(A类学校选做A类题,B类学校选做B类题,C类学校选做C类题。)(A类)若实验二中得到的碱式硫酸铜化学式为CuSO4•3Cu(OH)2 , 将该碱式硫酸铜浸泡在过量的氢氧化钠溶液中,密封放置一天后,固体全部变为蓝色。写出此反应的化学方程式:。
(B类)取12.9g某种碱式硫酸铜[化学式可表示为xCuSO4•yCu(OH)2],加热完全分解后生成0.9g水,则x︰y =。
(C类)取2份等质量的某种碱式硫酸铜[化学式可表示为xCuSO4•yCu(OH)2],一份加热完全分解后生成4.8g氧化铜,另一份可与20g质量分数为19.6%的稀硫酸恰好完全反应,则该碱式硫酸铜的化学式为。
三、计算题
-
21. 能源利用和环境保护是人类共同关注的问题。(1)、家用燃料的发展历程如下图所示,括号内的物质是该燃料的主要成分。

下列说法不正确的是 (填字母)。
A、煤、石油、天然气都是化石燃料 B、液化石油气是石油化工的一种产品 C、可燃冰将成为未来新能源,其中主要含有丙烷水合物 D、等质量的甲烷和丙烷完全燃烧,生成的二氧化碳质量相等(2)、煤燃烧时排放出SO2等污染物,可能导致降雨的酸性增强,我们把 pH5.6(填“>”、“<”或“=”)的降雨称为酸雨。将煤燃烧后的烟气通入吸收塔,用石灰水吸收其中的SO2 , 石灰水需要“喷淋”的目的是(填“增大”或“减小”)与烟气的接触面积,充分吸收SO2。(3)、在汽车尾气系统中安装催化转化器,可将有毒的CO、NO转化为无毒的CO2、N2 , 该反应中化合价发生变化的元素是(填元素符号)。(4)、2016年年初,诺贝尔化学奖获得者乔治·欧拉教授率领团队,首次采用基于金属钌的催化剂,将从空气中捕获的二氧化碳直接转化为甲醇燃料,转化率高达79%。二氧化碳转化为甲醇的化学方程式可表示为CO2+3H2 CH3OH+。(5)、乙醇是实验室常用的燃料。如果92g乙醇完全燃烧,至少需要氧气的质量是多少?(写出计算过程)