江苏省南京市江宁区2015-2016学年九年级第一次模拟化学考试试卷
试卷更新日期:2017-11-20 类型:中考模拟
一、选择题
-
1. 下列生活中的物品主要由有机合成材料制成的是( )A、羊毛手套 B、纯棉衬衫 C、真丝围巾 D、尼龙背包2. 下列实验现象描述正确的是( )A、硫在氧气中燃烧产生大量的白烟 B、红磷在空气中燃烧发出淡蓝色火焰 C、镁条在空气中燃烧生成氧化镁 D、铁丝在氧气中剧烈燃烧,火星四射3. 下列有关灭火原理的说法中,不正确的是( )A、清除可燃物 B、降低可燃物的着火点 C、隔绝空气 D、使温度降到可燃物的着火点以下4. 下列粒子结构示意图中,表示阴离子的是( )A、
 B、
B、 C、
C、 D、
D、 5. 下列属于复合肥的是( )A、KCl B、CO(NH2)2 C、(NH4)2HPO4 D、K2SO46. 小兵同学利用棉签设计了如右图实验,a处滴浓氨水,b处滴酚酞溶液,过一会儿,他观察到b处的棉花变红,a处的棉花不变红。下列说法不正确的是( )
5. 下列属于复合肥的是( )A、KCl B、CO(NH2)2 C、(NH4)2HPO4 D、K2SO46. 小兵同学利用棉签设计了如右图实验,a处滴浓氨水,b处滴酚酞溶液,过一会儿,他观察到b处的棉花变红,a处的棉花不变红。下列说法不正确的是( ) A、氨分子在不断的运动 B、氨水的pH大于7 C、所有分子的运动速率相等 D、该实验药品用量少并能有效防止氨气逸出7. 在常温下,要验证铝、锌、铜的金属活动性顺序,宜选用下列哪组物质进行实验( )A、铝、铜、硫酸锌溶液 B、锌、铜、氯化铝溶液 C、铝、氧化铜、硫酸锌溶液 D、铜、氯化铝溶液、氯化锌溶液8. 下列各组离子在水溶液中能大量共存的是( )A、Ca2+、CO32-、OH-、Na+ B、Na+、SO42-、OH-、Cl- C、Ba2+、H+、OH-、Cl- D、NH4+、NO3-、OH-、K+9. 用右图所示实验装置进行二氧化碳性质实验,其中甲中的液体具有吸收水蒸气的作用,乙中小花为紫色石蕊溶液浸泡后晒干的纸花。实验过程:①关闭Ⅰ、打开Ⅱ;②关闭Ⅱ、打开Ⅰ。下列说法不正确的是( )
A、氨分子在不断的运动 B、氨水的pH大于7 C、所有分子的运动速率相等 D、该实验药品用量少并能有效防止氨气逸出7. 在常温下,要验证铝、锌、铜的金属活动性顺序,宜选用下列哪组物质进行实验( )A、铝、铜、硫酸锌溶液 B、锌、铜、氯化铝溶液 C、铝、氧化铜、硫酸锌溶液 D、铜、氯化铝溶液、氯化锌溶液8. 下列各组离子在水溶液中能大量共存的是( )A、Ca2+、CO32-、OH-、Na+ B、Na+、SO42-、OH-、Cl- C、Ba2+、H+、OH-、Cl- D、NH4+、NO3-、OH-、K+9. 用右图所示实验装置进行二氧化碳性质实验,其中甲中的液体具有吸收水蒸气的作用,乙中小花为紫色石蕊溶液浸泡后晒干的纸花。实验过程:①关闭Ⅰ、打开Ⅱ;②关闭Ⅱ、打开Ⅰ。下列说法不正确的是( ) A、实验过程①中紫色小花不变红 B、实验过程②中紫色小花变红 C、使紫色小花变红的是二氧化碳 D、该实验证明二氧化碳能与水发生反应10. 下列各组转化中,在一定条件下均能一步实现的组合是( )
A、实验过程①中紫色小花不变红 B、实验过程②中紫色小花变红 C、使紫色小花变红的是二氧化碳 D、该实验证明二氧化碳能与水发生反应10. 下列各组转化中,在一定条件下均能一步实现的组合是( )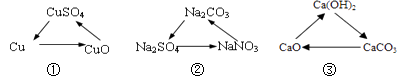 A、①②③ B、①② C、①③ D、②③11. 甲、乙两种不含结晶水的固体物质的溶解度曲线如右图所示,下列说法中不正确的是( )
A、①②③ B、①② C、①③ D、②③11. 甲、乙两种不含结晶水的固体物质的溶解度曲线如右图所示,下列说法中不正确的是( ) A、t1℃时,50g甲的饱和溶液中溶解了10g的甲 B、将t2℃时的甲、乙两种物质的饱和溶液升温至t3℃(溶剂的量不变),两种溶液中溶质的质量分数相等 C、t2℃时,要使接近饱和的乙溶液达到饱和状态,可以采用蒸发溶剂的方法 D、甲物质的饱和溶液中含有少量乙,可采用降温结晶的方法分离提纯甲12. 测得CO、CO2和N2的混合气体中碳元素的质量分数为24%,则其中氧元素的质量分数可能是( )
A、t1℃时,50g甲的饱和溶液中溶解了10g的甲 B、将t2℃时的甲、乙两种物质的饱和溶液升温至t3℃(溶剂的量不变),两种溶液中溶质的质量分数相等 C、t2℃时,要使接近饱和的乙溶液达到饱和状态,可以采用蒸发溶剂的方法 D、甲物质的饱和溶液中含有少量乙,可采用降温结晶的方法分离提纯甲12. 测得CO、CO2和N2的混合气体中碳元素的质量分数为24%,则其中氧元素的质量分数可能是( )
A、10% B、30% C、50% D、70%13. 在一定条件下,一个密闭容器内发生某反应,测得反应前后各物质的质量如下表所示。下列有关说法不正确的是( ) A、参加反应的c与d的质量之比为2:1 B、x的取值范围一定是:0≤x≤30 C、当y≤20时,该反应一定是化合反应 D、x + y = 6514. 下列图示实验操作中,不正确的是( )A、加热液体
A、参加反应的c与d的质量之比为2:1 B、x的取值范围一定是:0≤x≤30 C、当y≤20时,该反应一定是化合反应 D、x + y = 6514. 下列图示实验操作中,不正确的是( )A、加热液体 B、检查装置气密性
B、检查装置气密性 C、蒸发食盐水
C、蒸发食盐水 D、稀释浓硫酸
D、稀释浓硫酸 15. 下表列出了除去物质中所含少量杂质的方法,其中不正确的是( )
15. 下表列出了除去物质中所含少量杂质的方法,其中不正确的是( )选项
物质
所含杂质
除去杂质的方法
A
N2
O2
将气体缓缓通过足量的灼热铜网
B
CaO
CaCO3
加水溶解、过滤
C
NaOH
Na2CO3
加适量的Ca(OH)2溶液、过滤
D
FeCl2
CuCl2
加入过量的铁粉,充分反应后过滤
A、A B、B C、C D、D二、填空题
-
16. 根据下图回答问题。
 (1)、实验仪器a的名称是。(2)、实验室用高锰酸钾制取氧气的化学方程式为 , 所选用的发生装置是。(3)、实验室制取并收集二氧化碳选用的装置是 , 检验二氧化碳是否收集满的方法是。(4)、某小组同学利用下图所示装置探究铁丝生锈的条件,其中C、D的分液漏斗中为足量且浓度和体积均相同的稀盐酸。
(1)、实验仪器a的名称是。(2)、实验室用高锰酸钾制取氧气的化学方程式为 , 所选用的发生装置是。(3)、实验室制取并收集二氧化碳选用的装置是 , 检验二氧化碳是否收集满的方法是。(4)、某小组同学利用下图所示装置探究铁丝生锈的条件,其中C、D的分液漏斗中为足量且浓度和体积均相同的稀盐酸。
①步骤一:关闭K2和K3 , 打开K1 , A中产生大量气泡。 为保证后续实验的成功,B中所盛放的溶液是。对比铁丝表面的变化,能够说明铁丝生锈与水有关的最佳装置是(填“C”、“D”或“E”,下同),能够说明铁丝生锈的快慢与氧气浓度有关的装置是。
②步骤二:关闭K1 , 打开K2和K3 , 将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,C瓶中现象是;D瓶中溶液变成黄色反应的化学方程式为 , 由此也可以判断铁丝生锈情况。
17. 水是生命之源,人类的日常生活与工农业生产都离不开水。 (1)、图1为电解水的实验装置图。接通电源后观察两电极都有气泡产生,发生反应的化学方程式为 , 通电一段时间后,玻璃管a收集到的气体是。(2)、已知同温同压下,气体的体积比决定于气体的分子数之比。该实验中能说明水的化学式为“H2O”的实验现象是。(3)、在日常生活中,人们常采用的方法降低水的硬度。(4)、海水淡化可采用膜分离技术。如图2所示,对淡化膜右侧的海水加压,水分子可透过淡化膜进入左侧淡水池,而海水中各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分的变化分析正确的 。
(1)、图1为电解水的实验装置图。接通电源后观察两电极都有气泡产生,发生反应的化学方程式为 , 通电一段时间后,玻璃管a收集到的气体是。(2)、已知同温同压下,气体的体积比决定于气体的分子数之比。该实验中能说明水的化学式为“H2O”的实验现象是。(3)、在日常生活中,人们常采用的方法降低水的硬度。(4)、海水淡化可采用膜分离技术。如图2所示,对淡化膜右侧的海水加压,水分子可透过淡化膜进入左侧淡水池,而海水中各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分的变化分析正确的 。 A、溶质质量增加 B、溶剂质量减少 C、溶液质量不变 D、溶质质量分数减少(5)、甲、乙两个城市全年雨水的月平均pH变化如图3。下列说法正确的是 。
A、溶质质量增加 B、溶剂质量减少 C、溶液质量不变 D、溶质质量分数减少(5)、甲、乙两个城市全年雨水的月平均pH变化如图3。下列说法正确的是 。 A、甲城市受酸雨的影响较严重 B、pH小于7的降雨称为酸雨 C、煤的大量燃烧是造成酸雨的主要原因之一 D、大力推广使用脱硫煤可以减少酸雨的形成18. 在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。(1)、在C60、金刚石、硫酸铜三种物质中,由分子构成的物质是。(2)、通过分析组成和结构,可以预测物质的某些性质。根据右图硫酸氢钠溶液的微观图示,分析推测NaHSO4的性质,其中合理的是 。
A、甲城市受酸雨的影响较严重 B、pH小于7的降雨称为酸雨 C、煤的大量燃烧是造成酸雨的主要原因之一 D、大力推广使用脱硫煤可以减少酸雨的形成18. 在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。(1)、在C60、金刚石、硫酸铜三种物质中,由分子构成的物质是。(2)、通过分析组成和结构,可以预测物质的某些性质。根据右图硫酸氢钠溶液的微观图示,分析推测NaHSO4的性质,其中合理的是 。 A、其水溶液能与金属铁发生置换反应,得到金属钠 B、其水溶液能使紫色石蕊试液变红 C、其水溶液能与金属锌反应生成氢气 D、其水溶液与硝酸钡溶液反应生成硫酸钡沉淀(3)、从微观角度解释下列问题:
A、其水溶液能与金属铁发生置换反应,得到金属钠 B、其水溶液能使紫色石蕊试液变红 C、其水溶液能与金属锌反应生成氢气 D、其水溶液与硝酸钡溶液反应生成硫酸钡沉淀(3)、从微观角度解释下列问题:①一氧化碳和二氧化碳化学性质不同的原因是;
②金刚石和石墨物理性质差异很大的原因是。
(4)、以化合价为纵坐标,以物质的类别为横坐标所绘制的图像叫价类图。下图为铁的价类图,请分析该图后填写:
①A点表示的物质类别是。B点表示化合物的化学式为。
②某化合物化学式为(NH4)2Fe(SO4)2 , 它代表的点是。(填“A、B、C、D、E”)
③写出由C点表示的化合物与氧气、水发生化合反应生成D的化学方程式。
19. 如图是初中化学中常见物质间的转化关系,其中,在通常情况下,F、G是组成元素相同的两种气体;Q、R都是黑色粉末;E是生活中常用的调味品(图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应条件和生成物略去)。请回答: (1)、A、G的化学式为: , 。(2)、反应②的化学方程式为;
(1)、A、G的化学式为: , 。(2)、反应②的化学方程式为;反应③的化学方程式为。
三、计算题
-
20. 某化学兴趣小组在实验室配制一定溶质质量分数的稀盐酸,并用其测定某氢氧化钠溶液的溶质的质量分数。
实验一:37%的浓盐酸(密度为1.19g/mL)、氢氧化钠溶液、蒸馏水、量筒、细口瓶等
(1)、实验步骤:①计算:配制74g质量分数为10%的稀盐酸,需要37%的浓盐酸的体积为mL(精确到0.1mL,下同);需要蒸馏水的体积为mL(水的密度为1.0g/mL)。
②量取:用量筒分别量取相应的浓盐酸和蒸馏水。
③。
④装瓶并贴上标签。
(2)、实验二:用上述配制的稀盐酸加入到20g某氢氧化钠溶液中,溶液pH的变化情况如下图所示。
试计算该氢氧化钠溶液中溶质的质量分数。(在答题卡上写出计算过程)
四、探究题
-
21. 电石,学名碳化钙(CaC2),以焦炭和碳酸钙为原料生产碳化钙并制备重要工业原料乙炔(CxHy)气体的原理如下图。

【实验探究】
(1)、气体C有毒,写出固体A和焦炭反应得到碳化钙的化学方程式为。(2)、小组同学对固体D提出三种猜想:猜想一:氧化钙;
猜想二:氢氧化钙;
猜想三:碳酸钙。
同学们经过分析将猜想一排除了,理由是。
(3)、检验固体D:取样,滴加足量的稀盐酸,观察到 , 猜想二正确。(4)、【组成测定】(一)实验设计:
将一定量的乙炔(CxHy)在足量的氧气中完全燃烧,生成的气体全部缓缓通过下图装置(选填“Ⅰ”或“Ⅱ”)。
 (5)、(二)实验测定:(小资料:乙炔的相对分子质量为26)
(5)、(二)实验测定:(小资料:乙炔的相对分子质量为26)实验数据记录于下表中,试通过计算,确定乙炔的化学式。
反应前质量/g
反应后质量/g
装置①
125.3
127.1
装置②
78.2
87.0
结论:乙炔的化学式。
(6)、【归纳小结】写出碳化钙与水反应的化学方程式:。
-