2015-2016学年河北省邯郸市四县联考高一下学期期中化学试卷
试卷更新日期:2016-08-25 类型:期中考试
一、单项选择题
-
1. 化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )A、CO2的电子式:






 B、质量数为37的氯原子: Cl
C、NH4Cl的电子式:
B、质量数为37的氯原子: Cl
C、NH4Cl的电子式:  D、原子核内有10个中子的氧原子: O
2. 下列物质中,各原子的最外层电子满足8电子稳定结构的分子是( )A、CO2 B、N2O5 C、PCl5 D、NaCl3. 下列物质加热熔化时,所克服粒子间相互作用力属于同类型的是( )A、食盐和金属钠的熔化 B、氯化铵和单质硫的熔化 C、碘和干冰的升华 D、金刚石和石灰石的熔化4. 下列说法中正确的是( )A、原子及其离子的核外电子层数等于该元素所在的周期数 B、元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素 C、第ⅠA族元素的金属性比第ⅡA族元素的金属性强 D、在周期表里,主族元素所在的族序数等于原子核外电子数5. 电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH﹣﹣2e﹣→Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e﹣→2Ag+2OH﹣ , 总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列说法正确的是( )A、锌是正极,氧化银是负极 B、锌发生还原反应,氧化银发生氧化反应 C、溶液中OH﹣向正极移动,K+、H+向负极移动 D、随着电极反应的不断进行,电解质溶液中KOH的质量分数不断增大6. 下表给出了X,Y,Z,W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是( )
D、原子核内有10个中子的氧原子: O
2. 下列物质中,各原子的最外层电子满足8电子稳定结构的分子是( )A、CO2 B、N2O5 C、PCl5 D、NaCl3. 下列物质加热熔化时,所克服粒子间相互作用力属于同类型的是( )A、食盐和金属钠的熔化 B、氯化铵和单质硫的熔化 C、碘和干冰的升华 D、金刚石和石灰石的熔化4. 下列说法中正确的是( )A、原子及其离子的核外电子层数等于该元素所在的周期数 B、元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素 C、第ⅠA族元素的金属性比第ⅡA族元素的金属性强 D、在周期表里,主族元素所在的族序数等于原子核外电子数5. 电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH﹣﹣2e﹣→Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e﹣→2Ag+2OH﹣ , 总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列说法正确的是( )A、锌是正极,氧化银是负极 B、锌发生还原反应,氧化银发生氧化反应 C、溶液中OH﹣向正极移动,K+、H+向负极移动 D、随着电极反应的不断进行,电解质溶液中KOH的质量分数不断增大6. 下表给出了X,Y,Z,W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是( )元素
X
Y
Z
W
原子半径(nm)
0.102
0.130
0.073
0.071
最高正价或最低负价
+6
+2
﹣2
﹣1,W无正价
A、HW水溶液可以保存在玻璃瓶中 B、X的单质与Z的单质反应生成XZ3 C、Z的最高正价为+6 D、原子序数X>Y>W>Z7. 反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )A、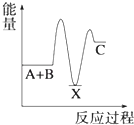 B、
B、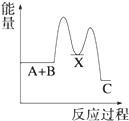 C、
C、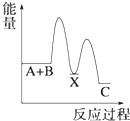 D、
D、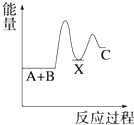 8. 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
8. 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( ) A、杠杆为导体和绝缘体时,均为A端高,B端低 B、杠杆为导体和绝缘体时,均为A端低,B端高 C、当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 D、当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高9. 在四个不同容器中,不同条件下进行合成氨反应.根据在相同时间内测定的结果判断生成氨的速率最快的是( )A、v(N2)=0.1mol•L﹣1•s﹣1 B、v(H2)=0.1mol•L﹣1•min﹣1 C、v(NH3)=0.15mol•L﹣1•min﹣1 D、v(H2)=0.3mol•L﹣1•min﹣110. 下列结论正确的是( )
A、杠杆为导体和绝缘体时,均为A端高,B端低 B、杠杆为导体和绝缘体时,均为A端低,B端高 C、当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 D、当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高9. 在四个不同容器中,不同条件下进行合成氨反应.根据在相同时间内测定的结果判断生成氨的速率最快的是( )A、v(N2)=0.1mol•L﹣1•s﹣1 B、v(H2)=0.1mol•L﹣1•min﹣1 C、v(NH3)=0.15mol•L﹣1•min﹣1 D、v(H2)=0.3mol•L﹣1•min﹣110. 下列结论正确的是( )①粒子半径:K+>Al3+>S2﹣>Cl﹣
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2﹣>Cl﹣>Br﹣>I﹣
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
A、②⑤⑦ B、②④⑥ C、②④⑤⑥⑦ D、②⑥⑦11. 下列属于吸热反应的是( )①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠溶于水
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华.
A、①④ B、②④ C、③⑤ D、④⑥12. 四种短周期元素的离子aXm+、bYn+、cZn﹣、dRm﹣ , 它们具有相同的电子层结构,若m>n,对下列叙述正确的是( )①a﹣b=n﹣m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
⑤还原性Rm﹣>Zn﹣
⑥X一定可与冷水反应.
A、只有②正确 B、①②③④正确 C、①②③⑥正确 D、②③⑤正确13. 下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是( )A、2Na+2H2O=2NaOH+H2↑ B、2Na2O2+2CO2=2Na2CO3+O2 C、Cl2+H2O⇌HCl+HClO D、Na2CO3+BaCl2=BaCO3↓+2NaCl14. 下列关于化学键说法正确的是( )A、构成单质分子的微粒中不一定含有化学键 B、只含有共价键的物质一定是共价化合物 C、NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键 D、CaCl2 中既有共价键又有离子键15. A,B是短周期元素,两元素能形成B2A型离子化合物,B离子比A离子少一个电子层,已知A的原子序数为n,则B的原子序数为( )A、n﹣5 B、n+3 C、n+13 D、n﹣1316. 在2L密闭容器中发生反应N2+3H2⇋2NH3 , 经一段时间后NH3 的物质的量增加了2.4mol,这段时间内用氢气表示的反应速率为0.6mol/(L•s),则这段时间为( )A、6 s B、4 s C、3 s D、2 s17. 甲、乙是元素周期表中同一周期的两种元素,甲位于ⅡA族,其原子序数为x,乙位于ⅢA族,则乙的原子序数可能是( )①x+1 ②x+11 ③x+25 ④x+26 ⑤x+10.
A、① B、②③ C、①②③ D、全部二、填空题.
-
18. 请将正确的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解.
(1)、化学键没有被破坏的是;(2)、仅发生离子键破坏的是;(3)、仅发生共价键破坏的是;(4)、既发生离子键又发生共价键破坏的是;(5)、已知拆开1mol H﹣H键、1molN≡N、1mol N﹣H键分别需要吸收的能量为436kJ、946k J、391kJ.则由N2和H2反应生成1mol NH3需要放出的热量.19. 写出下列物质的电子式:(1)、MgCl2;(2)、NaOH;(3)、HClO;(4)、H2O2 .20. 下列各项分别与哪个影响化学反应速率因素的关系最为密切?(1)、夏天的食品易变霉,在冬天不易发生该现象 .(2)、同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢 .(3)、MnO2加入双氧水中放出气泡更快 .21. 在一定温度下,4L密闭容器内某一反应中气体M,气体N的物质的量随时间变化的曲线如图所示: (1)、比较t2时刻,正逆反应速率大小v正 v逆 . (填“>”、“=”、“<”)
(1)、比较t2时刻,正逆反应速率大小v正 v逆 . (填“>”、“=”、“<”)
(2)、若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:(3)、t3时刻化学反应达到平衡时反应物的转化率为(4)、如果升高温度则v逆(填增大、减小或不变).
22. 图1是部分短周期元素的常见化合价与原子序数的关系图: (1)、元素F在周期表中的位置 .(2)、DH其所含化学键类型为 .(3)、C、D、G对应的简单离子半径大小顺序是 . (用离子符号回答)(4)、某同学设计实验装置如图2,证明A、B、F的非金属性强弱关系:
(1)、元素F在周期表中的位置 .(2)、DH其所含化学键类型为 .(3)、C、D、G对应的简单离子半径大小顺序是 . (用离子符号回答)(4)、某同学设计实验装置如图2,证明A、B、F的非金属性强弱关系:①溶液a和溶液b分别为 , .
②溶液c中的离子反应方程式为 .
23. H、 H、 H互为 , 16O2、18O3互为 .A.同位素 B.相同物质 C.同素异形体 D.同分异构体.