2015-2016学年安徽省合肥市中科大附中高二下学期期中化学试卷(文科)
试卷更新日期:2016-08-25 类型:期中考试
一、选择题
-
1. 配制100mL 1.0mol•L﹣1Na2CO3溶液,下列操作正确的是( )A、称取28.6 g Na2CO3•10H2O,加入100 mL容量瓶中,加水溶解、定容 B、称取 28.6 g Na2CO3•10H2O,加入100 mL蒸馏水,搅拌、溶解 C、转移时将烧杯中溶液直接倒入容量瓶中 D、定容后,塞好瓶塞,反复倒转、摇匀2. 14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C.下列说法正确的是( )A、14C和14N互为同位素 B、14C和C60是同素异形体 C、 C核素中的中子数为8 D、14CO2的摩尔质量为463. 下列关于实验操作的叙述中正确的是( )A、从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 B、可燃性气体点燃之前必须验纯 C、用胶头滴管向试管中滴加液体,一定要将滴管伸入试管中 D、用温度计搅拌溶液一定要慢慢搅拌4. 下列实验方案能达到目的是( )A、除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤 B、实验室获取少量纯净的水:蒸馏自来水 C、提纯混有少量硝酸钾的氯化钾:将混合物溶于热水中,再冷却、结晶并过滤 D、提取碘水中的碘:加入适量乙醇,振荡、静置、分液5. 下列各组物质的性质比较,正确的是( )A、酸性:HClO4>H2SO4>H3PO4 B、氢化物稳定性:H2S>HF>H2O C、碱性:NaOH>Mg(OH)2>Ca(OH)2 D、氧化性:F2>Cl2>Br2>I26. 下列离子方程式书写不正确的是( )A、常温下氯气与烧碱溶液反应:Cl2+2OH ﹣═Cl﹣+ClO﹣+H2O B、AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ C、铜与稀硝酸反应:Cu+2H+═Cu2++H2↑ D、FeCl3溶液中加入KSCN:Fe3++3SCN﹣═Fe(SCN)37. 某元素的微粒37X﹣的核外电子数为18,则该元素原子的中子数是( )A、17 B、18 C、19 D、208. 下列装置能够组成原电池的是( )A、
 B、
B、 C、
C、 D、
D、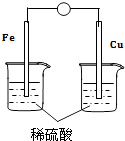 9. 为了使广东的天更蓝,空气更清新,目前我省某些城市对没有申领到“绿色”通行证的高污染车实行限行.高污染车排出的尾气中所含的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有( )A、二氧化碳 B、氮氧化物 C、水蒸气 D、氮气10. 实验室用乙酸、乙醇、浓H2SO4制取乙酸乙酯,加热蒸馏后,在饱和Na2CO3溶液的液面上得到无色油状液体,当振荡混合物时,有气泡产生,主要原因可能是( )A、有部分H2SO4 , 被蒸馏出来了 B、有部分未反应的乙醇被蒸馏出来了 C、有部分未反应的乙酸被蒸馏出来了 D、有部分乙酸乙酯与碳酸钠反应了11. 下面的几种食谱中,你认为营养不均衡的是( )A、凉拌西红柿、白菜、豆腐、炖肉、米饭 B、排骨炖面筋、馒头、香菇、萝卜汤、虾皮炒油菜 C、酱牛肉、面包、果汁、生菜卷、玉米沙拉 D、凉拌芹菜、海米、豆腐汤、肉丁炸酱、西红柿炒鸡蛋12. 明矾净水的作用是( )A、除去水中氯离子 B、除去水中钙离子 C、除去水中悬浮 D、消毒杀菌13. 从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于( )
9. 为了使广东的天更蓝,空气更清新,目前我省某些城市对没有申领到“绿色”通行证的高污染车实行限行.高污染车排出的尾气中所含的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有( )A、二氧化碳 B、氮氧化物 C、水蒸气 D、氮气10. 实验室用乙酸、乙醇、浓H2SO4制取乙酸乙酯,加热蒸馏后,在饱和Na2CO3溶液的液面上得到无色油状液体,当振荡混合物时,有气泡产生,主要原因可能是( )A、有部分H2SO4 , 被蒸馏出来了 B、有部分未反应的乙醇被蒸馏出来了 C、有部分未反应的乙酸被蒸馏出来了 D、有部分乙酸乙酯与碳酸钠反应了11. 下面的几种食谱中,你认为营养不均衡的是( )A、凉拌西红柿、白菜、豆腐、炖肉、米饭 B、排骨炖面筋、馒头、香菇、萝卜汤、虾皮炒油菜 C、酱牛肉、面包、果汁、生菜卷、玉米沙拉 D、凉拌芹菜、海米、豆腐汤、肉丁炸酱、西红柿炒鸡蛋12. 明矾净水的作用是( )A、除去水中氯离子 B、除去水中钙离子 C、除去水中悬浮 D、消毒杀菌13. 从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于( ) A、金属的导电性强弱 B、金属在地壳中的含量多少 C、金属的化合价高低 D、金属的活动性大小14. 材料是人类赖以生存的重要物质基础.下列有关材料的说法中正确是( )A、生活中的玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要使用石灰石 B、合金材料钢铁里的铁和碳在潮湿的空气中因构成许多原电池而易发生电化学腐蚀 C、居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体 D、造成“白色污染”的聚氯乙烯塑料在日常生活中可用来进行食品包装15. 目前已有包括我国在内的多个国家试制无冷却式陶瓷发动机汽车,使热效率大幅度提高.可用作制造这种发动机的耐高温材料是( )A、氮化硅陶瓷 B、水泥 C、光导纤维 D、玻璃钢16. 下列酸与金属发生反应时,硫元素或氮元素的化合价不发生变化的是( )A、浓硫酸 B、稀硝酸 C、浓硝酸 D、稀硫酸17. 下列仪器常用于物质分离的是( )
A、金属的导电性强弱 B、金属在地壳中的含量多少 C、金属的化合价高低 D、金属的活动性大小14. 材料是人类赖以生存的重要物质基础.下列有关材料的说法中正确是( )A、生活中的玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要使用石灰石 B、合金材料钢铁里的铁和碳在潮湿的空气中因构成许多原电池而易发生电化学腐蚀 C、居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体 D、造成“白色污染”的聚氯乙烯塑料在日常生活中可用来进行食品包装15. 目前已有包括我国在内的多个国家试制无冷却式陶瓷发动机汽车,使热效率大幅度提高.可用作制造这种发动机的耐高温材料是( )A、氮化硅陶瓷 B、水泥 C、光导纤维 D、玻璃钢16. 下列酸与金属发生反应时,硫元素或氮元素的化合价不发生变化的是( )A、浓硫酸 B、稀硝酸 C、浓硝酸 D、稀硫酸17. 下列仪器常用于物质分离的是( )①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥研钵.
A、①③④ B、①②⑥ C、①③⑤ D、①③⑥18. 与50mL0.1moL/LNa2CO3溶液中的钠离子的物质的量浓度相同的溶液是( )A、50mL0.2moL/L的NaCl溶液 B、100mL0.1moL/L的NaCl溶液 C、25mL0.2moL/L的Na2SO4溶液 D、10mL0.5moL/L的Na2CO3溶液19. 下列叙述正确的是( )A、1mol任何气体的体积一定是22.4L B、同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同 C、在标准状况下,体积为22.4L的物质都是1mol D、在非标准状况下,1mol任何气体的体积不可能是22.4L20. 下列物质不能通过化合反应得到的物质是( )A、CuCl2 B、FeCl2 C、FeS D、CuS21. 下列有关金属及化合物的说法正确的是( )A、地壳中含量最多的元素是铝元素 B、在自然界中铝以化合态存在 C、NaCl的焰色反应呈紫色 D、白色絮状沉淀Fe(OH)2可溶于NaOH溶液中22. 下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )①NaHCO3②Al2O3③Al(OH)3 ④Al.
A、③④ B、②③④ C、①③④ D、全部23. 下列灭火剂能用于扑灭金属钠着火的是( )A、干冰灭火剂 B、黄砂 C、干粉(含NaHCO3)灭火剂 D、泡沫灭火剂24. 纯碱和小苏打都是白色固体,在日常生活中都可以找到.要将它们区分开,下面的方法可行的是( )A、分别放在炒锅中加热,观察是否有残留物 B、分别用干净铁丝蘸取样品在煤气火焰上灼烧,观察火焰的颜色 C、用水杯各盛相同质量的样品,分别加入等体积的白醋,观察反应剧烈的程度 D、将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀25. 能正确表示下列化学反应的离子方程式的是( )A、氢氧化钡溶液与硫酸的反应 OH﹣+H+=H2O B、澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O C、铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag D、碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑26. 从硫元素的化合价判断,含硫元素的下列物质只作还原剂的是( )A、Na2S B、S C、SO2 D、H2SO427. 下列变化过程中,属于还原反应的是( )A、HCl→Cl2 B、Na→Na+ C、CO→CO2 D、Fe3+→Fe28. 下列物质属于纯净物的是( )A、漂白粉 B、盐酸 C、碘酒 D、液氯29. Na2CO3俗名纯碱,下列对Na2CO3采用不同分类法的分类.不正确的是( )A、Na2CO3是碱 B、Na2CO3是盐 C、Na2CO3是正盐 D、Na2CO3是钠盐30. 在强酸性溶液中,可以大量共存的离子组是( )A、Na+、K+、CH3COO﹣、Cl﹣ B、Ba2+、Na+、CO 、NO C、Na+、Ag+、SO 、Cl﹣ D、Al3+、Fe3+、NO 、SO二、综合题
-
31. ①②③④⑤五种元素,在元素周期表中的位置如图所示.回答下列问题:
 (1)、上述五种元素中,金属性最强的元素在周期表中的位置是 , 该元素的单质在空气中燃烧的化学方程为 .(2)、元素①和③可以形成众多的化合物,其中最简单的是(写化学式) , 该化合物中,化学键的类型为(填“离子键”或“共价键”).(3)、试用电子式表示元素⑤单质分子的形成过程 .32. 在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体化合物、B为金属单质,D、E、M是常见气体单质,其中I为红褐色固体,M为黄绿色,N是胃酸的主要成分,工业上用E和M来制取N,试推断:
(1)、上述五种元素中,金属性最强的元素在周期表中的位置是 , 该元素的单质在空气中燃烧的化学方程为 .(2)、元素①和③可以形成众多的化合物,其中最简单的是(写化学式) , 该化合物中,化学键的类型为(填“离子键”或“共价键”).(3)、试用电子式表示元素⑤单质分子的形成过程 .32. 在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体化合物、B为金属单质,D、E、M是常见气体单质,其中I为红褐色固体,M为黄绿色,N是胃酸的主要成分,工业上用E和M来制取N,试推断: (1)、写出下列化学式AI(2)、G转化为I的现象为(3)、F+M→H离子方程式为(4)、A+X→C+D的化学方程式为 .33. 某生活污水有一股臭味,主要含有碎菜叶、碎塑料薄膜、泥沙、氯化钠和碳酸钠等物质.现欲将其经去渣、除臭处理后用作清洗厕所的用水,问:(1)、采用何种操作,可除去污水中的碎菜叶,碎塑料薄膜及泥沙?(2)、用什么物质可除去污水中的臭味?(答对一种即可)(3)、把生活污水进行处理再利用的目的是什么?(4)、样检验(1)和(2)处理后的水中是否存在氯离子? .
(1)、写出下列化学式AI(2)、G转化为I的现象为(3)、F+M→H离子方程式为(4)、A+X→C+D的化学方程式为 .33. 某生活污水有一股臭味,主要含有碎菜叶、碎塑料薄膜、泥沙、氯化钠和碳酸钠等物质.现欲将其经去渣、除臭处理后用作清洗厕所的用水,问:(1)、采用何种操作,可除去污水中的碎菜叶,碎塑料薄膜及泥沙?(2)、用什么物质可除去污水中的臭味?(答对一种即可)(3)、把生活污水进行处理再利用的目的是什么?(4)、样检验(1)和(2)处理后的水中是否存在氯离子? .三、计算题
-
34. 铁粉和氧化亚铁粉末的混合物共9.2克,加入到150毫升的稀硫酸中,恰好完全反应,得到氢气2.24升(标准状况).求:(1)、混合物中铁和氧化亚铁的质量?(2)、原稀硫酸的物质的量浓度?