备考2018年高考化学一轮基础复习:专题7 铝及其化合物
试卷更新日期:2017-11-17 类型:一轮复习
一、单选题
-
1. 为了除去铝表面的铜镀层,可选用的试剂是( )A、烧碱溶液 B、盐酸 C、稀硝酸 D、浓硝酸2. 属于铝热反应的是( )A、Al+HCl B、Al+H2SO4 C、Al+MgO D、Al+MnO23. 下列操作可得纯净Al2O3的是( )A、向NaAlO2溶液中加入适量的稀硫酸后,蒸干并灼烧 B、向NaAlO2溶液中通入过量的CO2后,过滤并灼烧 C、向AlCl3溶液中加入适量的NaAlO2溶液后,蒸干并灼烧 D、向AlCl3溶液中加入过量的NaOH溶液后,过滤并灼烧4. 下列物质中,既能与盐酸反应,又能跟NaOH溶液反应的化合物是( )
①NH4HCO3②Na2SO4③Al2O3④Al(OH)3⑤Al.
A、①③④⑤ B、②③④ C、①③④ D、①②③④5. 图示意铝在氧气中燃烧的实验,铝条点燃后,为维持燃烧继续,正确的操作是( )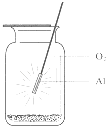 A、铝条应始终置于集气瓶瓶口位置 B、迅速将铝条插入集气瓶接近瓶底位置 C、将铝条从瓶口位置慢慢伸向瓶底位置 D、铝条应不断上下移动6. 下列有关金属铝及其化合物的叙述正确的是( )A、铝在常温下不能与氧气反应 B、铝合金的强度和硬度都比纯铝的大 C、足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气 D、铝在常温下不能与冷的浓硫酸和浓硝酸反应7. 将足量的两份铝,分别加入到等物质的量的盐酸和氢氧化钠溶液中,放出气体的物质的量之比为( )A、3:2 B、2:3 C、1:1 D、1:38. 下列关于镁铝化学性质的表述不正确的是( )
A、铝条应始终置于集气瓶瓶口位置 B、迅速将铝条插入集气瓶接近瓶底位置 C、将铝条从瓶口位置慢慢伸向瓶底位置 D、铝条应不断上下移动6. 下列有关金属铝及其化合物的叙述正确的是( )A、铝在常温下不能与氧气反应 B、铝合金的强度和硬度都比纯铝的大 C、足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气 D、铝在常温下不能与冷的浓硫酸和浓硝酸反应7. 将足量的两份铝,分别加入到等物质的量的盐酸和氢氧化钠溶液中,放出气体的物质的量之比为( )A、3:2 B、2:3 C、1:1 D、1:38. 下列关于镁铝化学性质的表述不正确的是( )铝
镁
A.与非金属反应
能被Cl2、O2氧化
能与N2、O2反应
B.与水反应
常温下难与水反应
常温下能与水缓慢反应
C.与碱反应
能溶于碱溶液
能溶于碱溶液
D.与某些氧化物反应
能与Fe2O3、MnO2、C如O3等金属氧化物发生铝热反应
能在CO2中燃烧
A、A B、B C、C D、D9. 将少量的铝投入过量的氢氧化钠溶液中充分反应,下列有关所得混合溶液的叙述正确的是( )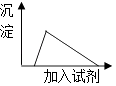 A、该溶液中,Ag+、K+、NH4+、SO42﹣可以大量共存 B、该溶液中,Na+、OH﹣、NO3﹣、CO32﹣不能大量共存 C、向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图 D、向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图
A、该溶液中,Ag+、K+、NH4+、SO42﹣可以大量共存 B、该溶液中,Na+、OH﹣、NO3﹣、CO32﹣不能大量共存 C、向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图 D、向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图二、填空题
-
10. 向一金属铝的易拉罐内充满CO2 , 然后向罐内注入足量NaOH溶液,立即用胶布严封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,解释上述变化的实验现象:
(1)罐壁内凹而瘪的原因: 离子方程式:
(2)罐壁重新鼓起的原因: 离子方程式: .
11. 铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应.如:2Al+Fe2O3 2Fe+Al2O3 , 反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
(1)、“铝热反应”属于四种基本反应类型中的反应.(2)、信息中的“某些”指(填“比铝活泼的”“比铝不活泼的”或“任意”).(3)、试写出铝粉与MnO2发生的铝热反应方程式 .(4)、铝热反应可用于野外焊接钢轨,原因是 .12. 向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示.则:(1)写出OA段发生反应的离子方程式:OA段 ,图中线段OP:PB= .
(2)计算原AlCl3溶液的物质的量浓度为 mol/L
(3)图中A对应的横坐标为 mL
(4)当加入5mL NaOH溶液时,产生沉淀量为 mol.
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为 .
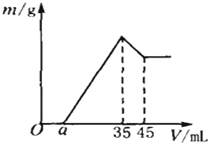
 13. 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,求:
13. 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,求:(1)原溶液中c(H2SO4)= mol/L
(2)若a=2.3mL,计算各组分的质量:
m(Al2O3)= g;m(Fe2O3)= g;
(3)计算a值的取值范围: <a< .
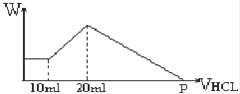
 14. 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:
14. 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:(1)混合物中NaOH的物质的量为 ,
(2)混合物中AlCl3质量为 ,
(3)混合物中MgCl2质量为 ,
(4)P点表示盐酸的体积是 .
 15.
15.某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质.利用拜耳法生产氧化铝的流程如图所示:

(1)粉碎后的铝土矿碱浸时应在高温下进行,其目的是 .
(2)AlO(OH)与NaOH反应的化学方程式为 .
(3)在稀释、结晶过程中:稀释的目的是 ;加Al(OH)3晶核的目的是促进Al(OH)3的析出.上述“稀释、结晶”工艺,也可用通入足量的 气体的方法来代替.
(4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式: .
(5)该生产流程能实现 (填化学式)的循环利用.