备考2018年高考化学一轮基础复习:专题6 钠、镁及其化合物
试卷更新日期:2017-11-17 类型:一轮复习
一、单选题
-
1. 关于钠元素的单质及其化合物的叙述中,不正确的是( )A、钠是银白色、质软、熔点相对较低、密度比水小的金属单质 B、大量的钠着火时可以用沙子扑灭 C、金属钠在空气中长期放置,最终变为碳酸钠 D、过氧化钠是白色固体2. 在CO2中,Mg燃烧生成MgO和C.下列说法正确的是( )A、在该反应条件下,Mg的还原性强于C的还原性 B、Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg) C、元素C的单质只存在金刚石和石墨两种同素异形体 D、该反应中化学能全部转化为热能3. 下列操作正确的是( )A、向盛水的烧杯中投入小拇指大小的钠块,观察现象 B、将钠保存在汽油中 C、将一小块钠放在石棉网上加热,观察现象 D、用手掰开一块金属钠,观察钠的颜色4. 甲、乙、丙之间具有如图所示的转化关系.则甲不可能是( )
甲 乙 丙.
A、N2 B、C C、Mg D、Na5. 如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( ) A、反应③最多能产生0.1 mol O2 B、反应①的离子方程式为Na+2H2O═Na++2OH﹣+H2↑ C、Na2O2中阴阳离子数目之比为1:1 D、①②③充分反应后所得溶液中溶质的质量分数:②=③>①6. 下列物质能使品红溶液褪色,且褪色原理基本相同的是( )
A、反应③最多能产生0.1 mol O2 B、反应①的离子方程式为Na+2H2O═Na++2OH﹣+H2↑ C、Na2O2中阴阳离子数目之比为1:1 D、①②③充分反应后所得溶液中溶质的质量分数:②=③>①6. 下列物质能使品红溶液褪色,且褪色原理基本相同的是( )⑴活性炭⑵氯水⑶二氧化硫⑷臭氧 ⑸过氧化钠 ⑹双氧水.
A、(1)(2)(4)(6) B、(1)(2)(3)(5) C、(2)(4)(5)(6) D、(3)(4)(5)(6)7. 下列有关表述与图象对应关系不正确的是( )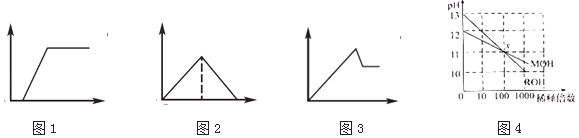 A、图1:往Na2CO3和NaOH混合液中逐滴加入盐酸,产生气体体积与盐酸的物质的量的关系 B、图2:往澄清石灰水中通入过量CO2气体,产生沉淀质量与CO2的物质的量的关系 C、图3:往AlCl3和MgCl2混合液中逐滴加入NaOH溶液,产生沉淀质量与NaOH溶液的物质的量的关系 D、图4:若MOH和ROH表示两种一元碱,则ROH的碱性强于MOH8. 下列物质间的转化在给定条件下能实现的是( )
A、图1:往Na2CO3和NaOH混合液中逐滴加入盐酸,产生气体体积与盐酸的物质的量的关系 B、图2:往澄清石灰水中通入过量CO2气体,产生沉淀质量与CO2的物质的量的关系 C、图3:往AlCl3和MgCl2混合液中逐滴加入NaOH溶液,产生沉淀质量与NaOH溶液的物质的量的关系 D、图4:若MOH和ROH表示两种一元碱,则ROH的碱性强于MOH8. 下列物质间的转化在给定条件下能实现的是( )①NH3 NO2 HNO3
②SiO2 Na2SiO3 H2SiO3
③Mg(OH)2 MgCl2(aq) Mg
④Na Na2O2 Na2CO3 .
A、②④ B、③④ C、①④ D、①②③9. 下列说法正确的是( )A、7.8gNa2S和Na2O2的固体混合物中含有的阴离子数目为0.1NA B、用铜做电极电解CuSO4溶液的反应方程式:2Cu2++2H2O 2Cu+O2↑+4H+ C、等质量的N2和CO所含原子数均为2NA D、pH等于2的醋酸溶液中加入0.01mol/L的盐酸,溶液pH会变小二、填空题
-
10. 向碳酸钠的浓溶液中逐滴加入稀盐酸,到不再产生CO2气体为止.在此过程中,溶液中的碳酸氢根离子浓度的变化趋势可能是(从下面的选项中选择),反应过程中有关离子方程式为: , .
①逐渐减小 ②逐渐增大 ③先逐渐增大,然后减小④先逐渐减小,然后增大.
11. 吸面具中常用Na2O2来做供氧剂,发生反应2Na2O2+2CO2═2Na2CO3+O2↑,在反应中Na2O2是:CO2是:(填氧化剂,还原剂,既不是氧化剂也不是还原剂),若有1mol的O2生成,转移了mol的电子;Na2O2中阴阳离子个数比;0.5mol CO2中,有mol电子,mol碳原子,在标准状况下所占有的体积 , 含有的O原子个数 , 摩尔质量 .12. A同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体.但他在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体.物 质
MgO
MgCl2
Mg3N2
Mg(NO3)2
MgCO3
Mg(OH)2
颜 色
白色
白色
淡黄色
白色
白色
白色
[提出问题]为什么会生成淡黄色固体?
[查阅资料]该同学查阅资料,记录了右
表中几种物质的颜色:
(1)其他同学认为不必查阅氯化镁的颜色,理由是 ;
(2)[提出猜想]分析资料,A同学认为淡黄色固体可能是由镁与空气中的 反应生成的;
(3)[实验探究]该同学设计实验证实了自己的猜想,他的方案可能是 将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体 ;
(4)[实验结论]根据该同学的实验结果,写出镁条在空气中燃烧时发生的两个反应的化学方程式: 、 ;
(5)[反思与评价]通过上述实验,你对燃烧有什么新的认识? .
三、综合题
-
13. 如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:
 (1)、实验中观察到的现象是 .A、试管中镁片逐渐溶解 B、试管中产生无色气泡 C、烧杯外壁变冷 D、烧杯底部析出少量白色固体(2)、试管中发生的反应属于(选填“氧化还原反应”或“非氧化还原反应”).(3)、写出有关反应的离子方程式 .(4)、由实验推知,MgCl2溶液和H2的总能量(填“大于”“小于”“等于”)镁片和盐酸的总能量.14. 取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题:
(1)、实验中观察到的现象是 .A、试管中镁片逐渐溶解 B、试管中产生无色气泡 C、烧杯外壁变冷 D、烧杯底部析出少量白色固体(2)、试管中发生的反应属于(选填“氧化还原反应”或“非氧化还原反应”).(3)、写出有关反应的离子方程式 .(4)、由实验推知,MgCl2溶液和H2的总能量(填“大于”“小于”“等于”)镁片和盐酸的总能量.14. 取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题: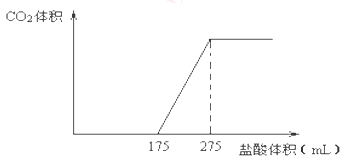 (1)、加入盐酸后总共产生的气体在标准状况下的体积为 L;(2)、盐酸中HCl的物质的量浓度;(3)、反应后的固体的成分(填化学式);(4)、x= .15. 某同学用如图所示装置制取纯净的氧气.试回答下列问题:
(1)、加入盐酸后总共产生的气体在标准状况下的体积为 L;(2)、盐酸中HCl的物质的量浓度;(3)、反应后的固体的成分(填化学式);(4)、x= .15. 某同学用如图所示装置制取纯净的氧气.试回答下列问题: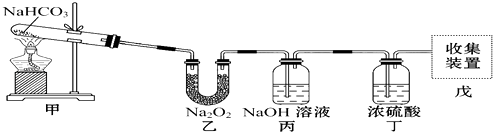 (1)、甲中发生的反应的化学方程式为:;乙中Na2O2可能发生的反应有(写化学方程式;(2)、丙中NaOH溶液的作用是 , 丁中浓硫酸的作用是 .(3)、若把原装置连接顺序改为甲→丙→丁→乙→戊,则在装置戊中能否收集到氧气?(填“能”或“不能”),原因是 .16. 由CO2、H2O(g)组成的混合气体共a mol,其中CO2的物质的量分数为x.将该混合气体缓慢通过装有1mol Na2O2的真空管,充分反应后,维持120℃、1.01×105Pa.收集所得气体,冷却、称量,真空管中固体质量增加y g.(1)、若a=1,则y=(用含x代数式表示);(2)、若a=2,x=0.5时,反应后所得气体的成分是;(3)、若a=2,y=28时,则x的取值范围;(4)、若a=1.25,试作出y与x的关系曲线,并在y轴标明曲线起点和终点的数值.17. 海水中含有丰富的Na+、Mg2+、Cl﹣、Br﹣等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.(1)、如图是采用膜分离技术的海水淡化示意图.淡化膜可以让水分子通过,而海水中其他分子和离子均不能通过.加压后,左侧淡水中增加的是(填字母).
(1)、甲中发生的反应的化学方程式为:;乙中Na2O2可能发生的反应有(写化学方程式;(2)、丙中NaOH溶液的作用是 , 丁中浓硫酸的作用是 .(3)、若把原装置连接顺序改为甲→丙→丁→乙→戊,则在装置戊中能否收集到氧气?(填“能”或“不能”),原因是 .16. 由CO2、H2O(g)组成的混合气体共a mol,其中CO2的物质的量分数为x.将该混合气体缓慢通过装有1mol Na2O2的真空管,充分反应后,维持120℃、1.01×105Pa.收集所得气体,冷却、称量,真空管中固体质量增加y g.(1)、若a=1,则y=(用含x代数式表示);(2)、若a=2,x=0.5时,反应后所得气体的成分是;(3)、若a=2,y=28时,则x的取值范围;(4)、若a=1.25,试作出y与x的关系曲线,并在y轴标明曲线起点和终点的数值.17. 海水中含有丰富的Na+、Mg2+、Cl﹣、Br﹣等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.(1)、如图是采用膜分离技术的海水淡化示意图.淡化膜可以让水分子通过,而海水中其他分子和离子均不能通过.加压后,左侧淡水中增加的是(填字母).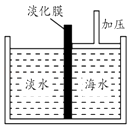
a.溶质质量 b.溶剂质量 c.溶质的质量分数
(2)、从海水中提取镁的主要步骤如下: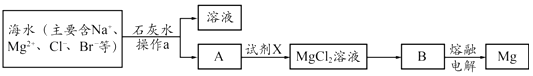
①操作a的名称是 .
②写出B冶炼金属镁的化学方程式 .
(3)、空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是以预先经过酸化的浓缩海水为原料,通过以下步骤提取溴:步骤一:用氯气置换溴离子使之成为单质溴;
步骤二:通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化成氢溴酸;
步骤三:用氯气将氢溴酸氧化得到产品溴.
①步骤一和步骤二的目的是 .
②步骤二中发生反应的化学方程式为 .