备考2018年高考化学一轮基础复习:专题5 电解质与离子反应
试卷更新日期:2017-11-17 类型:一轮复习
一、单选题
-
1. 能正确表达下列反应的离子方程式为( )A、用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O B、硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+ C、向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3
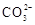 =Al2(CO3)3↓
D、用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH=
=Al2(CO3)3↓
D、用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH=  +
+  + H2O
2. 下列叙述正确的是( )A、NH4+、Al3+、Cl﹣、HCO3﹣在溶液中能大量共存 B、H2O2的电子式是:
+ H2O
2. 下列叙述正确的是( )A、NH4+、Al3+、Cl﹣、HCO3﹣在溶液中能大量共存 B、H2O2的电子式是: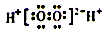 C、AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+
D、铁锈是化合物,可用Fe2O3•nH2O(2<n<3)表示
3. 下列电离方程式正确的是( )A、在熔化时NaHSO4=Na++H++SO42﹣ B、H2CO3⇌2H++CO32﹣ C、NaHCO3=Na++HCO3﹣ D、CaCO3 ⇌Ca2++CO32﹣4. 下列电离方程式书写错误的是( )A、HCO3﹣+H2O=H2CO3+OH﹣ B、HSO3﹣+H2O⇌SO32﹣+H3O+ C、熔融的NaHSO4电离:NaHSO4=Na++HSO4﹣ D、Al(OH)3=H++AlO2﹣+H2O5. 下列化学反应的离子方程式正确的是( )A、将少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO﹣═CaSO3↓+2HClO B、向稀氨水中通入少量CO2:2NH3•H2O+CO2═2NH4++CO32﹣+H2O C、用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ D、将醋酸滴入硅酸钠溶液中:SiO32﹣+2H+═H2SiO3↓6. 列反应的离子方程式正确的是( )A、用铂作电极电解MgCl2溶液:2Cl﹣+2H2O H2↑+Cl2↑+2OH﹣ B、以铜做电极电解硫酸铜溶液:2Cu2++2H2O 4H++2Cu+O2↑ C、甲烷/KOH燃料电池正极反应:O2+4H++4e﹣═2H2O D、高铁电池 3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH充电时的阳极反应:Fe(OH)3﹣3e﹣+5 OH﹣═FeO42﹣+4H2O7. 下列各组澄清溶液中离子能大量共存,且加入(或滴入)X试剂后发生反应的离子方程式书写正确的是( )
C、AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+
D、铁锈是化合物,可用Fe2O3•nH2O(2<n<3)表示
3. 下列电离方程式正确的是( )A、在熔化时NaHSO4=Na++H++SO42﹣ B、H2CO3⇌2H++CO32﹣ C、NaHCO3=Na++HCO3﹣ D、CaCO3 ⇌Ca2++CO32﹣4. 下列电离方程式书写错误的是( )A、HCO3﹣+H2O=H2CO3+OH﹣ B、HSO3﹣+H2O⇌SO32﹣+H3O+ C、熔融的NaHSO4电离:NaHSO4=Na++HSO4﹣ D、Al(OH)3=H++AlO2﹣+H2O5. 下列化学反应的离子方程式正确的是( )A、将少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO﹣═CaSO3↓+2HClO B、向稀氨水中通入少量CO2:2NH3•H2O+CO2═2NH4++CO32﹣+H2O C、用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ D、将醋酸滴入硅酸钠溶液中:SiO32﹣+2H+═H2SiO3↓6. 列反应的离子方程式正确的是( )A、用铂作电极电解MgCl2溶液:2Cl﹣+2H2O H2↑+Cl2↑+2OH﹣ B、以铜做电极电解硫酸铜溶液:2Cu2++2H2O 4H++2Cu+O2↑ C、甲烷/KOH燃料电池正极反应:O2+4H++4e﹣═2H2O D、高铁电池 3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH充电时的阳极反应:Fe(OH)3﹣3e﹣+5 OH﹣═FeO42﹣+4H2O7. 下列各组澄清溶液中离子能大量共存,且加入(或滴入)X试剂后发生反应的离子方程式书写正确的是( )选项
离子组
X试剂
离子方程式
A
K+、H+、SO42﹣
少量Ba(OH)2
Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
B
Fe2+、Cl﹣、H+
少量NaNO3
3Fe2++NO3﹣+4H+═NO↑+2H2O+3Fe3+
C
Na+、Fe3+、NO3﹣
过量KSCN
Fe3++3SCN﹣═Fe(SCN)3↓
D
NH4+、H+、HCO3﹣
过量NaOH
NH4++H++HCO3﹣+3OH﹣═NH3•H2O+2H2O+CO32﹣
A、A B、B C、C D、D二、填空题
-
8. ①向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液PH7(填>、<、=),离子反应总方程式:
②向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液PH7(填>、<、=),离子反应总方程式: .
9. 现有以下物质:其中属于强电解质的是 , 属于弱电解质的是 , 属于非电解质的是 , 能导电的是(以上均填序号)①CO2②AlCl3③NH4Cl ④熔融Na2CO3⑤蔗糖⑥铜 ⑦BaSO4⑧CH3COOH ⑨NaOH溶液 ⑩液态HCl.
10. 写出下列物质的电离方程式(1)、NaHSO4:(2)、NaHCO3:(3)、Fe2(SO4)3 .11. 写出下列物质在水溶液中的电离方程式:NaHSO4:
NaHCO3: .
12. 掌握电解质和非电解质的概念,能熟练判断一种物质是否是电解质是认识电解质的性质、研究离子反应的前提.以下有10种物质:①铜;②稀硫酸;③氯化氢;④氨气;⑤Na2CO3溶液;⑥CO2;⑦冰醋酸;⑧NaCl;⑨CaCO3;⑩Cl2 .按照表中提示的信息,把符合左栏条件的物质的序号填入右栏相应的位置.
序号
符合的条件
序号
❶
电解质
❷
非电解质
❸
强电解质
❹
弱电解质
❺
既不是电解质也不非电解质
❻
能导电的物质
三、综合题
-
13. 现有下列十种物质:①液态HCl ②NaHCO3③NaCl溶液 ④CO2⑤蔗糖晶体 ⑥Ba(OH)2⑦红褐色的氢氧化铁胶体 ⑧NH3•H2O ⑨空气 ⑩Al2(SO4)3(1)、上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH﹣=H2O,该反应的化学方程式为 ,(2)、⑧在水中的电离方程式为 ,(3)、胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式: .(4)、写出下列反应的离子方程式
向Ba(OH)2溶液中逐滴加入稀硫酸 .
向Ba(OH)2溶液中通入过量的CO2 .
14. 根据所学知识,完成下列各题:(1)、在标准状况下,气体A的密度为3.17g•L﹣1 , 则气体A的摩尔质量为;(2)、用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入某种物质M的饱和溶液,继续煮沸可制得一种红褐色胶体.①物质M的名称为 .
②下列关于M的水溶液和上述操作所得胶体的叙述,正确的是
A.M的水溶液是电中性的,所得胶体是带电的
B.二者分散质的粒子都不能透过半透膜
C.二者可用丁达尔效应区别
D.向两者中逐滴滴加盐酸溶液均无明显现象
若胶体中含有杂质M则可用法提纯此分散系.
(3)、同温同压下,同体积的CO2和CO,它们的分子数之比为 , 物质的量之比为 , 密度之比为 .(4)、V L硫酸铝溶液中含有m gAl3+ , 则溶液中SO42﹣的物质的量浓度是mol•L﹣1 , 硫酸铝的物质的量浓度是mol•L﹣1(5)、在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g.此混合物中CO和CO2的物质的量比是 , CO的体积分数是 , C和O的原子个数比是 .(6)、3.01×1023个OH﹣的质量为 , 含有电子的物质的量为 , 和克Na+含有的离子数相同.(7)、欲除去粗盐中的Ca2+ , Mg2+ , SO42﹣等杂志,溶解后可依次加入、、 , 过滤出沉淀后再加入 , 蒸发结晶即可.(填写化学式)15. NaHSO4是一种酸式盐.(1)、NaHSO4晶体熔化时的电离方程式为 .(2)、0.1mol•L﹣1的NaHSO4溶液的pH= .(3)、NaHSO4溶液与NaHCO3溶液反应的离子方程式为 .(4)、2mol•L﹣1NaHSO4与1mol•L﹣1Ba(OH)2溶液等体积混合,反应的离子方程式为 . 若在反应的溶液中继续滴加Ba(OH)2溶液,反应的离子方程式为 .