2015-2016学年湖北省宜昌市四校高二上学期联考化学试卷
试卷更新日期:2016-08-22 类型:期末考试
一、选择题
-
1. 下列说法正确的是( )A、糖类、油脂、蛋白质都是由C,H,O三种元素组成的 B、糖类、油脂、蛋白质都是高分子化合物 C、生物油和矿物油均可发生水解反应 D、煤的干馏、煤的气化,液化、石油裂化、乙烯聚合都属于化学变化2. 在冶金工业上,均不能用常见化学还原剂制得的金属组是( )A、Na、Ba、Mg、Al B、Na、K,Zn、Fe C、Zn、Fe、Cu、Ag D、Mg、Al、Zn、Fe3. 下列有关化学用语正确的是( )A、26Fe的价层电子排布式为3d64s2 B、35Br的电子排布式可简写为[Ar]4s24p5 C、NH4Cl的电子式为
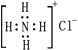 D、某基态原子核外电子排布图为:
D、某基态原子核外电子排布图为: 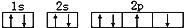 4. 下列说法中不正确的是( )A、第一电离能由大到小的顺序为N>O>C B、由于C 和O 为等电子体,所以可以判断O 的电子式为
4. 下列说法中不正确的是( )A、第一电离能由大到小的顺序为N>O>C B、由于C 和O 为等电子体,所以可以判断O 的电子式为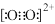 C、NO 中N采用sp2杂化,故NO 的空间构型为三角锥形
D、液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键
5. X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2和RY3 , Y和Z最外层电子数之和与W的最外层电子数相同,25℃时0.01mol•L﹣1 X和W形成化合物的水溶液pH为2,下列说法正确的是( )A、非金属性Y>R,则Y的最高价氧化物水化物的酸性高于R的最高价氧化物水化物的酸性 B、在Z、Y形成的两种离子化合物中阴阳离子的个数比分别为1:2和1:1 C、原子半径由大到小排列的是:Z>R>W>Y>X D、Y、Z、W三种元素组成化合物的水溶液一定显碱性6. 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
C、NO 中N采用sp2杂化,故NO 的空间构型为三角锥形
D、液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键
5. X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2和RY3 , Y和Z最外层电子数之和与W的最外层电子数相同,25℃时0.01mol•L﹣1 X和W形成化合物的水溶液pH为2,下列说法正确的是( )A、非金属性Y>R,则Y的最高价氧化物水化物的酸性高于R的最高价氧化物水化物的酸性 B、在Z、Y形成的两种离子化合物中阴阳离子的个数比分别为1:2和1:1 C、原子半径由大到小排列的是:Z>R>W>Y>X D、Y、Z、W三种元素组成化合物的水溶液一定显碱性6. 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )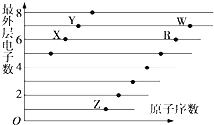 A、X和R在同一周期 B、原子半径:W>R>X C、气态氢化物的稳定性:X>Y D、X,Z形成的化合物中可能含有共价键7. 短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中;常温下,Z的单质能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
A、X和R在同一周期 B、原子半径:W>R>X C、气态氢化物的稳定性:X>Y D、X,Z形成的化合物中可能含有共价键7. 短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中;常温下,Z的单质能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
A、通过电解熔融的Z、Q形成的化合物可制取Z单质 B、原子半径的大小顺序为W>Q>Z>X>Y C、元素Y的最高正化合价为+6 D、XQ3分子中,中心原子是sp3杂化8. An+、B(n+1)+、Cn﹣、D(n+1)﹣的电子层结构相同.下列关于A,B,C,D四种元素的叙述正确的是( )A、气态氢化物的稳定性:D>C B、一定都是短周期元素 C、单质的还原性:B>A D、原子序数:B>A>C>D9. 下列说法正确的是( )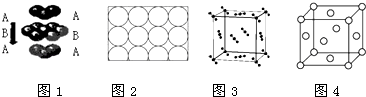 A、钛和钾都采取图1的堆积方式 B、图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积 C、图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围距离相等且为 acm的CO2有8个 D、图4这种金属晶体的晶胞,是金属原子在三维空间里以密置层采取ABCABC…堆积的结果10. CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C 的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )
A、钛和钾都采取图1的堆积方式 B、图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积 C、图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围距离相等且为 acm的CO2有8个 D、图4这种金属晶体的晶胞,是金属原子在三维空间里以密置层采取ABCABC…堆积的结果10. CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C 的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )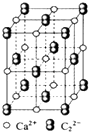 A、1个Ca2+周围距离最近且等距离的C22﹣数目为6 B、该晶体中的阴离子与F2是等电子体 C、6.4克CaC2晶体中含阴离子0.1mol D、与每个Ca2+距离相等且最近的Ca2+共有12个11. 某晶体的部分结构为正三棱柱(如图所示),这种晶体中A、B、C三种微粒数目之比为( )
A、1个Ca2+周围距离最近且等距离的C22﹣数目为6 B、该晶体中的阴离子与F2是等电子体 C、6.4克CaC2晶体中含阴离子0.1mol D、与每个Ca2+距离相等且最近的Ca2+共有12个11. 某晶体的部分结构为正三棱柱(如图所示),这种晶体中A、B、C三种微粒数目之比为( )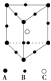 A、3:9:4 B、1:4:2 C、2:9:4 D、3:8:412. 下列说法中,正确的是( )A、冰熔化时,分子中H﹣O键发生断裂 B、原子晶体中,共价键的键长越短,通常熔点就越高 C、分子晶体中,共价键键能越大,该分子的熔沸点就越高 D、分子晶体中,分子间作用力越大,则分子越稳定13. 金属钠晶体为体心立方晶体(晶胞如图),实验测得钠的密度为ρ(g•cm﹣3).已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol﹣1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为( )
A、3:9:4 B、1:4:2 C、2:9:4 D、3:8:412. 下列说法中,正确的是( )A、冰熔化时,分子中H﹣O键发生断裂 B、原子晶体中,共价键的键长越短,通常熔点就越高 C、分子晶体中,共价键键能越大,该分子的熔沸点就越高 D、分子晶体中,分子间作用力越大,则分子越稳定13. 金属钠晶体为体心立方晶体(晶胞如图),实验测得钠的密度为ρ(g•cm﹣3).已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol﹣1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为( )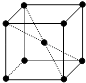 A、3 B、 ×3 C、 ×3 D、 ×314. 下列说法正确的是( )A、H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键 B、HF,HCl,HBr,HI的熔点沸点依次升高 C、乙醇分子与水分子之间只存在范德华力 D、氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO415. 石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则如图中7个六元环完全占有的碳原子数是( )
A、3 B、 ×3 C、 ×3 D、 ×314. 下列说法正确的是( )A、H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键 B、HF,HCl,HBr,HI的熔点沸点依次升高 C、乙醇分子与水分子之间只存在范德华力 D、氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO415. 石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则如图中7个六元环完全占有的碳原子数是( )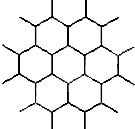 A、10个 B、14个 C、18个 D、21个16. 右图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽.接通电路后发现B上的c点显红色.为实现铁上镀锌,接通K后,使c、d两点短路.下列叙述正确的是( )
A、10个 B、14个 C、18个 D、21个16. 右图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽.接通电路后发现B上的c点显红色.为实现铁上镀锌,接通K后,使c、d两点短路.下列叙述正确的是( )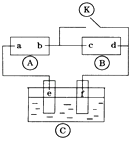 A、a为直流电源的负极 B、c极发生的反应为2H++2e﹣═H2↑ C、f电极为锌板 D、e极发生还原反应17.
A、a为直流电源的负极 B、c极发生的反应为2H++2e﹣═H2↑ C、f电极为锌板 D、e极发生还原反应17.如图所示的电化学装置,可用于净化处理厕所排放废水中的尿素(H2 NCON H2),同时产生电能.下列有关说法不正确的是( )
 A、右侧的多孔碳电极是原电池的负极 B、电解质溶液中H十向左侧移动 C、正极上发生还原反应:H2NCONH2+H2O﹣6e﹣═CO2+N2+6H+ D、电极上消耗标准状况下33.6LO2 , 电路中转移6 mol电子18. 从海带中提取碘单质,成熟的工艺流程如下:干海带 海带灰 悬浊液 滤液 碘水 I2的CCl4溶液 I2下列关于海水制碘的说法,不正确的是( )A、实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 B、含I﹣的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应 C、在碘水中加入几滴淀粉溶液,溶液变蓝色 D、碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”
A、右侧的多孔碳电极是原电池的负极 B、电解质溶液中H十向左侧移动 C、正极上发生还原反应:H2NCONH2+H2O﹣6e﹣═CO2+N2+6H+ D、电极上消耗标准状况下33.6LO2 , 电路中转移6 mol电子18. 从海带中提取碘单质,成熟的工艺流程如下:干海带 海带灰 悬浊液 滤液 碘水 I2的CCl4溶液 I2下列关于海水制碘的说法,不正确的是( )A、实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 B、含I﹣的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应 C、在碘水中加入几滴淀粉溶液,溶液变蓝色 D、碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”二、非选择题
-
19. 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.
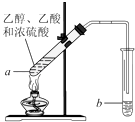 (1)、该实验反应物与生成物有机物的官能团种类有(填写名称).(2)、试管a中加入几块碎瓷片的目的是 .(3)、试管a中发生反应的化学方程式为 , 反应类型是 .(4)、反应开始前,试管b中盛放的溶液是 . 作用是 .(5)、反应结束后,振荡试管b,静置.反应结束后,试管b内的液体分成两层,乙酸乙酯在层(填写“上”或“下”).若分离10mL该液体混合物需要用到的主要玻璃仪器是 .20. 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.(1)、已知H2(g)和C(s)的燃烧热分别是285.8kJ•mol﹣1、393.5kJ•mol﹣1;计算反应
(1)、该实验反应物与生成物有机物的官能团种类有(填写名称).(2)、试管a中加入几块碎瓷片的目的是 .(3)、试管a中发生反应的化学方程式为 , 反应类型是 .(4)、反应开始前,试管b中盛放的溶液是 . 作用是 .(5)、反应结束后,振荡试管b,静置.反应结束后,试管b内的液体分成两层,乙酸乙酯在层(填写“上”或“下”).若分离10mL该液体混合物需要用到的主要玻璃仪器是 .20. 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.(1)、已知H2(g)和C(s)的燃烧热分别是285.8kJ•mol﹣1、393.5kJ•mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为;
(2)、工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)⇌CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将;
(3)、以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为;(4)、用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:请写出电解过程中Y电极附近观察到的现象;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液的pH=(假设溶液的体积不变,气体全部从溶液中逸出). 21. 某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
21. 某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:①用直流电电解氯化铜溶液,所用仪器如图.
②在电流强度为I A,通电时间为t s后,精确测得其电极上析出的铜的质量为m g.
试回答:
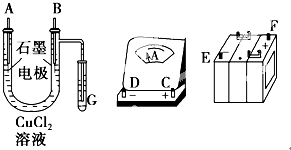 (1)、连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示,下同):E接D,C接 , 接F.(2)、写出B极上发生反应的电极反应式: , G试管中淀粉KI溶液变化的现象为 , 相应的离子方程式是 .(3)、为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是 .
(1)、连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示,下同):E接D,C接 , 接F.(2)、写出B极上发生反应的电极反应式: , G试管中淀粉KI溶液变化的现象为 , 相应的离子方程式是 .(3)、为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是 .①称量电解前电极质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜,后称量
⑥再次低温烘干后称量至恒重
(4)、已知电子的电量为1.6×10﹣19C.试列出阿伏加德罗常数的计算表达式:NA= .22. 卤块的主要成分是MgCl2 , 此外还含Fe3+、Fe2+和Mn2+等离子.若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁.
若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
物质
开始沉淀
沉淀完全
Fe(OH)3
2.7
3.7
Fe(OH)2
7.6
9.6
Mn(OH)2
8.3
9.8
Mg(OH)2
9.6
11.1
Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+ , 生成Fe(OH)3沉淀除去.
表2原料价格表
物质
价格/元・吨﹣1
漂液(含25.2%NaClO)
450
双氧水(含30%H2O2)
2400
烧碱(含98%NaOH)
2100
纯碱(含99.5%Na2CO3)
600
(1)、在步骤②中加入的试剂X,最佳的选择是 , 其作用是;(2)、在步骤③中加入的试剂应是;之所以要控制pH=9.8,其目的是;(3)、在步骤④中加入的试剂Z应是;(4)、在步骤⑤中发生的反应是 .23. 根据所学知识完成题目:(1)、中国古代四大发明之一﹣﹣黑火药,它的爆炸反应为:2KNO3+3C+S A+N2↑+3CO2↑(已配平)①除S外,上述元素的电负性从大到小依次为;
②在生成物中,含极性共价键的分子的中心原子轨道杂化类型为 , A的晶体类型为 .
③已知CN﹣与N2结构相似,推算HCN分子中σ键与π键数目之比为 .
(2)、原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2;T的基态原子外围电子(价电子)排布为 , Q2+的未成对电子数是 .(3)、在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6﹣n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R﹣H),可发生离子交换反应:[CrCln(H2O)6﹣n]x++xR﹣H→Rx[CrCln(H2O)6﹣n]+xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成.将含0.0015mol[CrCln(H2O)6﹣n]x+的溶液,与R﹣H完全交换后,中和生成的H+需浓度为0.1200mol•L﹣1NaOH溶液25.00mL,可知该配离子的化学式为 .