2015-2016学年河北省保定市高二上学期期末化学试卷
试卷更新日期:2016-08-22 类型:期末考试
一、单项选择题
-
1. 下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( )A、
 电解水
B、
电解水
B、 水力发电
C、
水力发电
C、 太阳能热水器
D、
太阳能热水器
D、 干电池
2. 下列物质,属于强电解质的是( )A、NH3•H2O B、H2O C、CH3COONH4 D、CH3COOH3. 下列叙述正确的是( )A、升高反应的温度,会使反应物的活化能迅速降低 B、乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” C、用电解水的方法制取大量氢气可以缓解能源不足的问题 D、推广使用太阳能、风能等能源,有利于缓解温室效应4. 常温下,纯水中存在电离平衡:H2O⇌H++OH﹣ . 欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是( )A、H2SO4 B、AlCl3 C、NaHCO3 D、NaOH5. 氯化铜溶液中含有少量氯化铁杂质,若要制得纯净的氯化铜,向溶液中加入下列试剂,不能达到目的是( )A、NaOH B、CuO C、Cu(OH)2 D、Cu2(OH)2CO36. 氯化银在水中存在溶解平衡:AgCl⇌Ag++Cl﹣ . 在相同温度下,将足量氯化银分别放入相同体积的下列溶液中,Ag+的浓度最小的是( )A、0.1mol/L HCl B、蒸馏水 C、0.1mol/LAlCl3 D、0.1mol/LMgCl27. 下列说法正确的是( )A、KW随浓度的改变而改变 B、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 C、对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 D、一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱8. 已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )A、H2O(g)=H2(g)+ O2(g)△H=+242kJ•mol﹣1 B、2H2(g)+O2(g)=2H2O(l)△H=﹣484kJ•mol﹣1 C、H2(g)+ O2(g)=H2O(g)△H=+242kJ•mol﹣1 D、2H2(g)+O2(g)=2H2O(g)△H=+484kJ•mol﹣19. 下列各项反应中,升高温度,平衡常数减小的是( )A、2SO3⇌2SO2+O2 B、H2PO +H2O⇌HPO +H3O+ C、Fe3++3H2O⇌Fe(OH)3+3H+ D、CH3COOH+OH﹣⇌CH3COO+H2O10. 在一定条件下,对于在密封容器中进行的反应:P(g)+Q(g)⇌R(g)+S(g),下列情况已经达到化学平衡状态的是( )A、P,Q,R,S的浓度相等 B、P,Q,R,S在密闭容器中共存 C、P,Q,R,S的浓度不再变化 D、容器内的压强不再变化11. 下列说法不正确的是( )A、钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e﹣=4 OH﹣ B、在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 C、铸铁输油管道应埋在干燥致密不透气的土壤中 D、白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化12. 反应4NH3+5O2⇌4NO+6H2O,在2L的密闭容器中进行,半分钟后,NO的物质的量增加了0.1mol,则此反应的平均反应速率表示正确的是( )A、v(NH3)=0.1mol•L﹣1•min﹣1 B、v(O2)=0.15mol•L﹣1•min﹣1 C、v(NO)=0.2mol•L﹣1•min﹣1 D、v(H2O)=0.25mol•L﹣1•min﹣113. 将固体NH4I置于密闭容器中,在某温度下发生下列反应NH4I(s)⇌NH3(g)+HI(g),2HI(g)⇌H2(g)+I2(g).当反应达到平衡时,c(H2)=0.5mol•L﹣1 , c(HI)=4mol•L﹣1 , 则NH3的浓度为( )A、3.5mol•L﹣1 B、4mol•L﹣1 C、4.5mol•L﹣1 D、5mol•L﹣114. 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH⇌CH3COO﹣+H+ , 要使溶液中 比值增大,可以采用的措施是( )A、加少量CH3COONH4固体 B、加浓醋酸 C、加少量NaCl固体 D、升高温度15. 反应I2+I﹣⇌I 达到平衡时c(I )与温度的关系如图所示.下列说法正确的是( )
干电池
2. 下列物质,属于强电解质的是( )A、NH3•H2O B、H2O C、CH3COONH4 D、CH3COOH3. 下列叙述正确的是( )A、升高反应的温度,会使反应物的活化能迅速降低 B、乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” C、用电解水的方法制取大量氢气可以缓解能源不足的问题 D、推广使用太阳能、风能等能源,有利于缓解温室效应4. 常温下,纯水中存在电离平衡:H2O⇌H++OH﹣ . 欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是( )A、H2SO4 B、AlCl3 C、NaHCO3 D、NaOH5. 氯化铜溶液中含有少量氯化铁杂质,若要制得纯净的氯化铜,向溶液中加入下列试剂,不能达到目的是( )A、NaOH B、CuO C、Cu(OH)2 D、Cu2(OH)2CO36. 氯化银在水中存在溶解平衡:AgCl⇌Ag++Cl﹣ . 在相同温度下,将足量氯化银分别放入相同体积的下列溶液中,Ag+的浓度最小的是( )A、0.1mol/L HCl B、蒸馏水 C、0.1mol/LAlCl3 D、0.1mol/LMgCl27. 下列说法正确的是( )A、KW随浓度的改变而改变 B、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 C、对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 D、一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱8. 已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )A、H2O(g)=H2(g)+ O2(g)△H=+242kJ•mol﹣1 B、2H2(g)+O2(g)=2H2O(l)△H=﹣484kJ•mol﹣1 C、H2(g)+ O2(g)=H2O(g)△H=+242kJ•mol﹣1 D、2H2(g)+O2(g)=2H2O(g)△H=+484kJ•mol﹣19. 下列各项反应中,升高温度,平衡常数减小的是( )A、2SO3⇌2SO2+O2 B、H2PO +H2O⇌HPO +H3O+ C、Fe3++3H2O⇌Fe(OH)3+3H+ D、CH3COOH+OH﹣⇌CH3COO+H2O10. 在一定条件下,对于在密封容器中进行的反应:P(g)+Q(g)⇌R(g)+S(g),下列情况已经达到化学平衡状态的是( )A、P,Q,R,S的浓度相等 B、P,Q,R,S在密闭容器中共存 C、P,Q,R,S的浓度不再变化 D、容器内的压强不再变化11. 下列说法不正确的是( )A、钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e﹣=4 OH﹣ B、在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 C、铸铁输油管道应埋在干燥致密不透气的土壤中 D、白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化12. 反应4NH3+5O2⇌4NO+6H2O,在2L的密闭容器中进行,半分钟后,NO的物质的量增加了0.1mol,则此反应的平均反应速率表示正确的是( )A、v(NH3)=0.1mol•L﹣1•min﹣1 B、v(O2)=0.15mol•L﹣1•min﹣1 C、v(NO)=0.2mol•L﹣1•min﹣1 D、v(H2O)=0.25mol•L﹣1•min﹣113. 将固体NH4I置于密闭容器中,在某温度下发生下列反应NH4I(s)⇌NH3(g)+HI(g),2HI(g)⇌H2(g)+I2(g).当反应达到平衡时,c(H2)=0.5mol•L﹣1 , c(HI)=4mol•L﹣1 , 则NH3的浓度为( )A、3.5mol•L﹣1 B、4mol•L﹣1 C、4.5mol•L﹣1 D、5mol•L﹣114. 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH⇌CH3COO﹣+H+ , 要使溶液中 比值增大,可以采用的措施是( )A、加少量CH3COONH4固体 B、加浓醋酸 C、加少量NaCl固体 D、升高温度15. 反应I2+I﹣⇌I 达到平衡时c(I )与温度的关系如图所示.下列说法正确的是( ) A、图中反应进行到状态D时,一定有v逆>v正 B、A点和B点的化学平衡常数相同 C、对B点溶液升高温度时,该反应△v正>△v逆 D、增大KI溶液浓度有利于I2的溶解16. 已知:2Zn(s)+O2(g)=2ZnO(s);△H=﹣701.0kJ•mol﹣1
A、图中反应进行到状态D时,一定有v逆>v正 B、A点和B点的化学平衡常数相同 C、对B点溶液升高温度时,该反应△v正>△v逆 D、增大KI溶液浓度有利于I2的溶解16. 已知:2Zn(s)+O2(g)=2ZnO(s);△H=﹣701.0kJ•mol﹣12Hg(l)+O2(g)=2HgO(s);△H=﹣181.6kJ•mol﹣1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
A、+519.4kJ•mol﹣1 B、+259.7 kJ•mol﹣1 C、﹣259.7kJ•mol﹣1 D、﹣519.4kJ•mol﹣117. 将如图所示实验装置的K闭合,下列判断正确的是( ) A、Cu电极上发生还原反应 B、电子沿Zn→a→b→Cu 路径流动 C、片刻后甲池中c(SO )增大 D、片刻后可观察到滤纸b点变红色
A、Cu电极上发生还原反应 B、电子沿Zn→a→b→Cu 路径流动 C、片刻后甲池中c(SO )增大 D、片刻后可观察到滤纸b点变红色二、填空题
-
18. 在常温下,下列五种溶液:①0.1mol/LNH4Cl②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4 ④0.1mol/L NH3•H2O和0.1mol/LNH4Cl混合液⑤0.1mol/LNH3•H2O,请根据要求填写下列空白:(1)、溶液①呈性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)(2)、在上述五种溶液中,pH最小的是;c(NH4+)最小的是(填序号)(3)、比较溶液②、③中c(NH4+)的大小关系是②③(填“>”、“<”或“=”)(4)、在溶液④中,离子的浓度为0.1mol/L;NH3•H2O和离子的物质的量浓度之和为0.2mol/L(5)、常温下,测得溶液②的pH=7,则说明CH3COO﹣的水解程度(填“>”、“<”或“=”)NH4+ 的水解程度,CH3COO﹣与NH4+浓度的大小关系是:c(CH3COO﹣) c(NH )(填“>”、“<”或“=”)19. 一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8molNO2 , 发生如下反应:2NO2(红棕色)⇌N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
 (1)、在该温度下,反应的化学平衡常数表达式为:(2)、若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol•L﹣1•s﹣1(3)、图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:(4)、t1时,正反应速率(填“>”、“<”或“=”)逆反应速率(5)、维持容器的温度不变,若缩小容器的体积,则平衡向移动(填“正反应方向”、“逆反应方向”或“不移动”)(6)、维持容器的体积不变,升高温度,达到新平衡时体系的颜色(填“变深”、“变浅”或“不变”)20. 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.
(1)、在该温度下,反应的化学平衡常数表达式为:(2)、若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol•L﹣1•s﹣1(3)、图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:(4)、t1时,正反应速率(填“>”、“<”或“=”)逆反应速率(5)、维持容器的温度不变,若缩小容器的体积,则平衡向移动(填“正反应方向”、“逆反应方向”或“不移动”)(6)、维持容器的体积不变,升高温度,达到新平衡时体系的颜色(填“变深”、“变浅”或“不变”)20. 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置. (1)、把化学能转化为电能的装置是(填“甲”或“乙”)(2)、④电极上的电极反应式为(3)、①电极上的电极反应式 , 检验该电极反应产物的方法是(4)、甲、乙两装置电极附近的溶液首先变红的电极分别是、(填序号)(5)、写出装置甲的反应总方程式 .
(1)、把化学能转化为电能的装置是(填“甲”或“乙”)(2)、④电极上的电极反应式为(3)、①电极上的电极反应式 , 检验该电极反应产物的方法是(4)、甲、乙两装置电极附近的溶液首先变红的电极分别是、(填序号)(5)、写出装置甲的反应总方程式 .三、实验题
-
21. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2﹣3次后,向其中注入0.1000mol•L﹣1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
滴定次数
待测液体积(mL)
标准盐酸体积/mL
滴定前读数(mL)
滴定后读数(mL)
第一次
25.00
0.50
20.40
第二次
25.00
4.00
24.00
试回答下列问题:
(1)、步骤③中锥形瓶中的溶液的颜色变化是由色时,停止滴定.(2)、滴定时边滴边摇动锥形瓶,眼睛应观察 .(3)、该小组在步骤①中的错误是 , 由此造成的测定结果(填“偏高”、“偏低”或“无影响”).(4)、步骤②缺少的操作是 .(5)、如图,是某次滴定时的滴定管中的液面,其读数为 mL.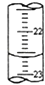
请计算待测烧碱溶液的浓度: mol/L.
四、选答题:[有机化学基础]
-
22. 化学测定有机物结构的分析方法很多,下列不属于测定有机物结构的分析方法的是( )A、核磁共振 B、红外光谱 C、同位素示踪法 D、质谱法23. 某气态化合物X含C,H,O三种元素,现已知下列条件:①X中C的质量分数;②X中H的质量分数;③X在标准状况下的体积;④X对氢气的相对密度;⑤X的质量.欲确定X的分子式,所需的最少条件是( )A、①②④ B、②③④ C、①③⑤ D、①②24. 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 解释或实验结论 称取9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 试通过计算填空 (1)A的相对分子质量为: (2)将此9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰、发现两者分别增重5.4g和13.2g (2)A的分子式为: (3)另取A9.0g,跟足量的NaHCO3粉末反应生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况) (3)用结构简式表示A中含有的官能团: (4)A的核磁共振氢谱如图: 
(4)A中含有种氢原子. (5)综上所述,A的结构简式为: . 五、[物质结构与性质]
-
25. He可作为核聚变材料,以下关于 He的叙述正确的是( )A、 He原子核内中子数为2 B、 He和 H是同一元素的不同原子 C、 He核外电子数为2 D、 He代表原子核内有2个质子和3个中子的氦原子26. 科学研究发现铂的两种化合物(短线表示化学健)有不同的特性,其中a具有抗癌作用,而b没有;则下列正确的说法是( )
 A、a、b分子中,Pt原子与2个Cl原子,2个N原子间形成的结构与CH2Cl2相似 B、a在水中的溶解度比b在水中的溶解度大 C、a、b互为同素异形体 D、a、b是同一物质27. A、B、C、D四种短周期元素,其原子序数依次增大,其中B与C同周期,A与D同主族,C元素的原子最外层电子数是次外层电子数的三倍,又知四种元素所形成的常见单质在常温常压下有三种是气体,一种是固体.
A、a、b分子中,Pt原子与2个Cl原子,2个N原子间形成的结构与CH2Cl2相似 B、a在水中的溶解度比b在水中的溶解度大 C、a、b互为同素异形体 D、a、b是同一物质27. A、B、C、D四种短周期元素,其原子序数依次增大,其中B与C同周期,A与D同主族,C元素的原子最外层电子数是次外层电子数的三倍,又知四种元素所形成的常见单质在常温常压下有三种是气体,一种是固体.请回答下列问题.
(1)、固体甲是由元素B、A形成的化合物BA5 , 它的所有原子的最外层都符合相应的稀有气体原子的最外层电结构,固体甲溶解于水有气体放出.则固体甲属于晶体,它的电子式为 . 固体甲溶于水后,溶液呈(酸、碱或中性),写出甲与水反应的化学方程式 .(2)、由C和D形成的化合物乙溶于水能生成一种气体,写出乙与水反应的化学方程式 .
-