备考2018年高考化学一轮基础复习:专题3溶液的配置与分析
试卷更新日期:2017-11-15 类型:一轮复习
一、单选题
-
1. 下列叙述中正确的是( )A、实验室欲配制480mL0.10mol•L﹣1的CuSO4溶液,可用12.0g胆矾及相应容器配制 B、将适量FeCl3饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体 C、实验室中从海带里提取碘的过程是:灼烧→溶解→过滤→萃取 D、用分液漏斗、烧杯、铁架台(带铁圈)、饱和Na2CO3溶液可除去乙酸乙酯中的乙酸2. 用固体样品配制一定物质的量浓度的溶液,需经过溶解、转移、定容、摇匀等操作.下列图示对应的操作不规范的是( )A、
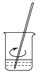 溶解
B、
溶解
B、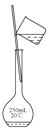 转移
C、
转移
C、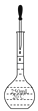 定容
D、
定容
D、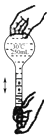 摇匀
3. 下列说法不正确的是( )A、配制一定物质的量浓度的溶液,向容量瓶加水至液面离刻度线1~2 cm时,改用胶头滴管定容 B、向某溶液中先加入Ba(NO3)2溶液,再加入足量的HNO3溶液,产生白色沉淀,则该溶液中一定含有SO C、分液操作时,将下层液体先放出,然后关闭旋塞,将上层液体从上口倒出 D、将油脂与氢氧化钠溶液混合充分反应后,再加入热的饱和食盐水,则可析出肥皂的主要成分4. 为了配制100mL1mol/L的NaOH溶液,其中有下列几个操作,错误的是( )
摇匀
3. 下列说法不正确的是( )A、配制一定物质的量浓度的溶液,向容量瓶加水至液面离刻度线1~2 cm时,改用胶头滴管定容 B、向某溶液中先加入Ba(NO3)2溶液,再加入足量的HNO3溶液,产生白色沉淀,则该溶液中一定含有SO C、分液操作时,将下层液体先放出,然后关闭旋塞,将上层液体从上口倒出 D、将油脂与氢氧化钠溶液混合充分反应后,再加入热的饱和食盐水,则可析出肥皂的主要成分4. 为了配制100mL1mol/L的NaOH溶液,其中有下列几个操作,错误的是( )①NaOH用称量纸盛装进行称量;
②选刚用蒸馏水洗净的100mL容量瓶进行配制;
③NaOH在烧杯里刚完全溶解时,立即将溶液转移到容量瓶;
④用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶;
⑤使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度线相切.
A、①③⑤ B、①⑤ C、②③⑤ D、①②5. 在T℃ 时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g•cm﹣3 , 溶质的质量分数为w,其中含NH3的物质的量为b mol.下列叙述中正确的是( )A、溶质的质量分数为w= ×100% B、溶质的物质的量浓度c= mol•L﹣1 C、溶液中c(OH﹣)= mol•L﹣1 D、上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w6. 已知20℃时,饱和NaCl溶液的密度为ρg/cm3 , 物质的量浓度为c mol/L,则下列说法中不正确的是( )A、温度低于20℃时,饱和NaCl溶液的浓度小于c mol/L B、此溶液中NaCl的质量分数为 C、20℃时,密度小于ρg/cm3的NaCl溶液是不饱和溶液 D、20℃时,饱和NaCl溶液的溶解度7. 25℃时,将10mL质量分数为50%(密度1.4g/mL)的硫酸稀释成100mL,下列说法正确的是( )A、纯硫酸的摩尔质量为98 B、上述100mL稀硫酸中含溶质14g C、上述稀释过程所需要的蒸馏水为90mL D、质量分数为50%的硫酸物质的量浓度为7.14mol/L二、填空题
-
8.
如图是硫酸试剂瓶标签上的内容:
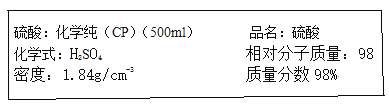
(1)该硫酸的物质的量浓度为 mol/L.
(2)某化学小组进行硫酸酸性实验探究时,需要240mL4.6mol/L的稀硫酸,则需要取上述的浓硫酸 mL.
(3)将上述浓硫酸进行稀释的实验操作是 .
(4)在配制4.6mol/L稀硫酸的过程中,下列情况对所配制硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)?
①未经冷却趁热将溶液注入容量瓶中: ;
②定容时仰视读数: ;
③用量筒量取浓硫酸时俯视 ;
④移液时不慎将少量溶液滴在容量瓶外面: .
(5)实验过程中出现下列情况应如何处理?
①向容量瓶中加入蒸馏水至距刻度线1~2cm时,应 ;
②加蒸馏水时不慎超过了刻度,应 .
9.病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签如图,则该注射液中葡萄糖的质量分数为 物质的量浓度为 .
 10. 实验室配制物质的量浓度均为0.2mol/L 的NaCl溶液和稀H2SO4 各480mL.提供的试剂是:NaCl固体和98%的浓H2SO4(密度为1.84g/cm3)及蒸馏水.(1)、应用托盘天平称量NaClg,应用10mL量筒量取H2SO4mL;(2)、配制两种溶液时都需要的仪器是;(3)、稀释浓H2SO4时应注意;(4)、在配制上述溶液实验中,下列操作引起结果偏低的有 (填序号)A、在烧杯中溶解溶质搅拌时,溅出少量溶液 B、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中 C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线 D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出 E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用 F、容量瓶刚用蒸馏水洗净,没有烘干 G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中. H、容量瓶加水定容时俯视刻度线.
10. 实验室配制物质的量浓度均为0.2mol/L 的NaCl溶液和稀H2SO4 各480mL.提供的试剂是:NaCl固体和98%的浓H2SO4(密度为1.84g/cm3)及蒸馏水.(1)、应用托盘天平称量NaClg,应用10mL量筒量取H2SO4mL;(2)、配制两种溶液时都需要的仪器是;(3)、稀释浓H2SO4时应注意;(4)、在配制上述溶液实验中,下列操作引起结果偏低的有 (填序号)A、在烧杯中溶解溶质搅拌时,溅出少量溶液 B、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中 C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线 D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出 E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用 F、容量瓶刚用蒸馏水洗净,没有烘干 G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中. H、容量瓶加水定容时俯视刻度线.三、综合题
-
11. 根据所学知识完成题目:(1)、30%的H2SO4和50%的H2SO4等质量混合后,所得溶液的质量分数(填“大于”、“小于”或“等于”)40%,如果等体积混合,混合后溶液的质量分数(填“大于”、“小于”或“等于”)40%.(2)、已知98%的浓H2SO4的物质的量浓度为18.4mol•L﹣1 , 试判断49%的H2SO4的物质的量浓度(填“大于”、“小于”或“等于”)9.2mol•L﹣1 .12. 某次实验需用0.4mol•L﹣1 NaOH溶液480mL.配制方法如下:(1)、用托盘天平准确称量 g 固体NaOH;(2)、将称量好的NaOH固体放在500mL大烧杯中,倒入约300mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待后,将烧杯中的溶液注入容量瓶中;(3)、用少量蒸馏水洗涤烧杯次,洗涤后的溶液 , 轻轻晃动容量瓶,使溶液混合均匀;(4)、向容量瓶中加入蒸馏水,到液面时,改用加蒸馏水至液面最低点与刻度线相切.盖好瓶塞,;(5)、若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是 , 偏低的是 , 对实验结果没有影响的是(填各选项的序号).
A.所用的NaOH中混有少量Na2O
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线.
13.某实验室需要配制500mL 0.10mol/L Na2CO3溶液.
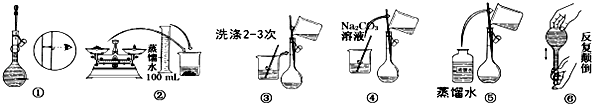 (1)、所需玻璃仪器有:玻璃棒、烧杯、100mL量筒、(2)、实验时图中所示操作的先后顺序为(填编号)(3)、在配制过程中,下列操作对所配溶液浓度有无影响?(填“偏高”、“偏低”或“无影响”)
(1)、所需玻璃仪器有:玻璃棒、烧杯、100mL量筒、(2)、实验时图中所示操作的先后顺序为(填编号)(3)、在配制过程中,下列操作对所配溶液浓度有无影响?(填“偏高”、“偏低”或“无影响”)①称量时误用“左码右物”
②转移溶液后没有洗涤烧杯和玻璃棒
③向容量瓶加水定容时俯视液面
④摇匀后液面下降,再加水至刻度线
(4)、所需Na2CO3固体的质量为g;若改用浓溶液稀释,需要量取2mol/L Na2CO3溶液mL.