备考2018年高考化学一轮基础复习:专题2 物质的量
试卷更新日期:2017-11-15 类型:一轮复习
一、单选题
-
1. 下列对于“摩尔”的理解不正确的是( )A、摩尔是一个物理量 B、摩尔是物质的量的单位,简称摩,符号为mol C、1mol12C与0.012kg12C所含碳原子数相同 D、1molO2约含6.02×1023个氧分子2. 下列说法中,错误的是( )A、2molH B、1mol H2O C、4mol e﹣ D、0.5mol 小米3.
为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程,下列叙述中不正确的是( )
 A、n=0.02 B、V=2240 C、m=3.2 D、元混合物中FeSO4的质量分数约为89%4. NA为阿伏加德罗常数的值。下列叙述错误的是( )A、1 mol 乙烯分子中含有的碳氢键数为4NA B、1 mol 甲烷完全燃烧转移的电子数为8NA C、1 L 0.1 mol·L−1的乙酸溶液中含H+的数量为0.1NA D、1 mol 的CO和N2混合气体中含有的质子数为14NA5. 物质的量相等的CO和CO2相比较,下列有关叙述中正确的是( )
A、n=0.02 B、V=2240 C、m=3.2 D、元混合物中FeSO4的质量分数约为89%4. NA为阿伏加德罗常数的值。下列叙述错误的是( )A、1 mol 乙烯分子中含有的碳氢键数为4NA B、1 mol 甲烷完全燃烧转移的电子数为8NA C、1 L 0.1 mol·L−1的乙酸溶液中含H+的数量为0.1NA D、1 mol 的CO和N2混合气体中含有的质子数为14NA5. 物质的量相等的CO和CO2相比较,下列有关叙述中正确的是( )①它们所含的分子数目之比为1:1
②它们所含的氧原子数目之比为1:2
③它们所含的原子总数目之比为2:3
④它们所含的C原子数目之比为1:1
⑤它们所含的电子数目之比为7:11.
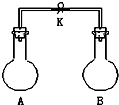
A、①和④ B、②和③ C、①②③④ D、①②③④⑤6. 在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同.试根据甲、乙的摩尔质量(M)的关系,判断下列说法中正确的是( )A、若M(甲)>M(乙),则分子数:甲>乙 B、若M(甲)<M(乙),则气体摩尔体积:甲>乙 C、若M(甲)<M(乙),则气体的压强:甲>乙 D、若M(甲)>M(乙),则气体体积:甲<乙7. 如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )编 号
①
②
③
④
A中气体
H2S
H2
NH3
NO
B中气体
SO2
Cl2
HCl
O2
 A、②③④① B、③①④② C、③②①④ D、④③②①8. 下列叙述的两个量,一定相等的是( )A、0.1 mol•L﹣1 NaCl与0.05 mol•L﹣1 Na2CO3溶液中的Na+数目 B、质量相等的金刚石与C60中的碳原子数目 C、标准状况下,等体积的SO2与SO3的分子数目 D、28 g乙烯气体和56g环丁烷(C4H8)气体中含有的碳原子数9. 物质X2CO3的饱和溶液V mL,密度为ρg/cm3 , X+的物质的量浓度为c mol/L,溶质的质量分数为a%,溶质的相对分子量为M,溶质的溶解度为s g.则下列表达式正确的是( )A、c= ×2 B、a= C、c= D、V×ρ×a%=10. 设NA为阿伏加德罗常数的值,标准状况下某O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积应是( )A、 L B、 C、 D、 L11. 与100mL0.1mol/L AlCl3溶液中Cl﹣的物质的量浓度相等的是( )A、50mL0.1mol/L NaCl溶液 B、50mL0.15mol/L MgCl2溶液 C、10mL1.0mol/L FeCl3溶液 D、100mL0.3mol/L KClO3溶液12. 设NA为阿伏加德罗常数值,下列说法不正确的是( )A、10 g D216O中所含中子数为5NA B、标准状况下,22.4 L乙烷中所含共价键数目为7NA C、7.8g Na2O2中所含阴、阳离子总数目为0.4NA D、密闭容器中,1 mol N2和3 mol H2充分反应后,容器中的分子数一定大于2NA
A、②③④① B、③①④② C、③②①④ D、④③②①8. 下列叙述的两个量,一定相等的是( )A、0.1 mol•L﹣1 NaCl与0.05 mol•L﹣1 Na2CO3溶液中的Na+数目 B、质量相等的金刚石与C60中的碳原子数目 C、标准状况下,等体积的SO2与SO3的分子数目 D、28 g乙烯气体和56g环丁烷(C4H8)气体中含有的碳原子数9. 物质X2CO3的饱和溶液V mL,密度为ρg/cm3 , X+的物质的量浓度为c mol/L,溶质的质量分数为a%,溶质的相对分子量为M,溶质的溶解度为s g.则下列表达式正确的是( )A、c= ×2 B、a= C、c= D、V×ρ×a%=10. 设NA为阿伏加德罗常数的值,标准状况下某O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积应是( )A、 L B、 C、 D、 L11. 与100mL0.1mol/L AlCl3溶液中Cl﹣的物质的量浓度相等的是( )A、50mL0.1mol/L NaCl溶液 B、50mL0.15mol/L MgCl2溶液 C、10mL1.0mol/L FeCl3溶液 D、100mL0.3mol/L KClO3溶液12. 设NA为阿伏加德罗常数值,下列说法不正确的是( )A、10 g D216O中所含中子数为5NA B、标准状况下,22.4 L乙烷中所含共价键数目为7NA C、7.8g Na2O2中所含阴、阳离子总数目为0.4NA D、密闭容器中,1 mol N2和3 mol H2充分反应后,容器中的分子数一定大于2NA二、填空题
-
13. (1)标况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为 ;
(2)某金属氯化物为MCl29.5g,含有0.200molCl﹣ , 则该氯化物的摩尔质量 , 金属M的相对原子质量为 .
(3)71.5g碳酸钠晶体(Na2CO3•10H2O)溶于水,配成500mL溶液,此溶液的物质的量浓度为 .
(4)质量都是10g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是 ;密度最小的是 .(填化学式)
14. (1)在标准状况下,1.7g氨气所占的体积为 L,它与标准状况下 L硫化氢含有相同数目的氢原子.(2)某气态氧化物的化学式为RO2 , 在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为 ,R的相对原子质量为 .
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该混合气体中含CO g,所含CO2在标准状况下的体积为 L.
(4)同温同压下,SO2与氦气的密度之比为 ;若质量相同,两种气体的体积比为
15. 同温同压下,同体积的N2和SO2分子数之比为 , 物质的量之比为 , 原子总数之比为 , 摩尔质量之比为 , 质量之比为 , 密度之比为 .三、综合题
-
16. 根据所学知识,完成下列各题:(1)、在标准状况下,气体A的密度为3.17g•L﹣1 , 则气体A的摩尔质量为;(2)、用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入某种物质M的饱和溶液,继续煮沸可制得一种红褐色胶体.
①物质M的名称为 .
②下列关于M的水溶液和上述操作所得胶体的叙述,正确的是
A.M的水溶液是电中性的,所得胶体是带电的
B.二者分散质的粒子都不能透过半透膜
C.二者可用丁达尔效应区别
D.向两者中逐滴滴加盐酸溶液均无明显现象
若胶体中含有杂质M则可用法提纯此分散系.
(3)、同温同压下,同体积的CO2和CO,它们的分子数之比为 , 物质的量之比为 , 密度之比为 .(4)、V L硫酸铝溶液中含有m gAl3+ , 则溶液中SO42﹣的物质的量浓度是mol•L﹣1 , 硫酸铝的物质的量浓度是mol•L﹣1(5)、在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g.此混合物中CO和CO2的物质的量比是 , CO的体积分数是 , C和O的原子个数比是 .(6)、3.01×1023个OH﹣的质量为 , 含有电子的物质的量为 , 和克Na+含有的离子数相同.(7)、欲除去粗盐中的Ca2+ , Mg2+ , SO42﹣等杂志,溶解后可依次加入、、 , 过滤出沉淀后再加入 , 蒸发结晶即可.(填写化学式)