2016年江西省萍乡市上栗县高考化学五模试卷
试卷更新日期:2016-08-19 类型:高考模拟
一、选择题
-
1. 在体积为V L的密闭容器中通入a mol CO和b mol O2 , 点燃充分反应后容器内碳原子数和氧原子数之比为( )A、a:b B、a:2b C、a:(a+2b) D、a:2(a+b)2. 一定温度下,反应2SO2+O2 2SO3 , 达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4.缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是( )A、0.6 mol B、0.4 mol C、0.8 mol D、1.2 mol3. 将下列各组溶液混合,不能发生复分解反应的是( )A、NaOH溶液、稀盐酸 B、NaCl溶液、KNO3溶液 C、Na2CO3溶液、澄清石灰水 D、Na2CO3溶液、稀硝酸4. 某密闭容器中,A(s)+3 B(g)⇌2 C(g)+D(g)△H>0在一定条件下达到平衡,下列说法正确的是( )A、加入少量A,B的转化率增大 B、升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 C、增大压强,平衡不移动,正、逆反应速率不变 D、加入催化剂,反应速率增大,平衡常数不变5. 一定量的某有机物和足量的钠反应,可得到气体VA L,等质量的该有机物与足量的纯碱溶液反应,可得到气体VB L.若同温、同压下VA>VB , 则该有机物可能是( )A、HO(CH2)2CHO B、HO(CH2)2COOH C、HOOC﹣COOH D、CH3COOH6. 为了更简便地制取干燥的NH3 , 适合的方法是( )A、NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥 B、N2+3H2 2NH3 , 用烧碱进行干燥 C、加热浓氨水,气体用碱石灰干燥 D、加热NH4HCO3 , 气体用P2O5干燥7. 某种只含Al、Fe、Cu的合金,称取a g样品,设计下列实验流程分析该合金的组成
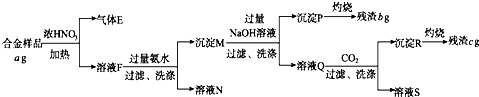
下列相关叙述正确的是( )
A、若向溶液F中加入K4[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液F中含有Fe2+ B、溶液N为深蓝色,说明溶液N中含大量Cu2+ C、合金样品中Cu的质量分数为 ×100% D、合金样品中Al的质量分数为 ×100%8. 有0.1mol•L﹣1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )A、溶液①中,c(CH3COO﹣)=c(H+) B、溶液①、②等体积混合,混合液中c(CH3COO﹣)等于溶液③中的c(CH3COO﹣) C、溶液①、②等体积混合,混合液中c(CH3COO﹣)+c(CH3COOH)=c(Na+) D、溶液①、③等体积混合,混合液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)二、非选择题
-
9. 在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题:
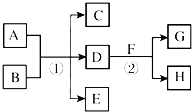 (1)、高温下发生的反应②中,若F为常见的金属单质,H是非金属单质,用化学方程式表示G的一个重要用途: .(2)、若F为淡黄色粉末,
(1)、高温下发生的反应②中,若F为常见的金属单质,H是非金属单质,用化学方程式表示G的一个重要用途: .(2)、若F为淡黄色粉末,①写出反应②的化学方程式并用双线桥标出电子转移的方向和数目 .
②F的电子式 .
(3)、若A是一种强酸,B是一含有两种金属元素的盐,且其水溶液显碱性,写出①反应的离子方程式 .(4)、若A、F、H是短周期且相邻的两个族的元素单质,且反应均在溶液中进行,请写出:①的离子方程式;
②的化学方程式 .
10. 四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.W
X
Y
Z
结构或性质
最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物
焰色反应呈黄色
在同周期主族元素形成的简单离子中,离子半径最小
最高正价与最低负价之和为零
(1)、Z在元素周期表中位于族.(2)、上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是(填元素符号).(3)、①下列可作为比较X和Y金属性强弱的依据是(填序号).a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因: .
(4)、W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是 , 混合后溶液中离子浓度由大到小的顺序是 .(5)、Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.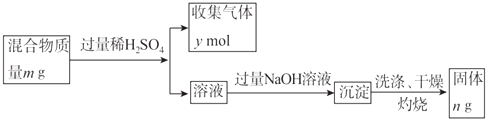
能确定混合物中Y的质量分数的数据有(填序号).
a.m、n b.m、y c.n、y.
11. 现有五种可溶性物质甲、乙、丙、丁、戊,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Al3+、Cu2+、Ba2+、Fe3+和五种阴离子Cl﹣、OH﹣、NO 、CO 、X中的一种.(1)、某同学通过分析比较,认为无需检验就可判断其中必有的两种物质是和 . (填化学式)(2)、物质丙中含有离子X.为了确定X,现将(1)中的两种物质记为甲和乙,当丙与甲的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀硝酸,沉淀部分溶解,剩余白色固体,则物质丙为 . (填化学式)(3)、将19.2g Cu投入装有足量丁溶液的试管中,Cu不溶解,再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式 , 若要将Cu完全溶解,至少加入硫酸的物质的量是 .(4)、戊溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 .12. (氧氮杂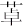 是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质.下面是某研究小组提出的一种氧氮杂
是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质.下面是某研究小组提出的一种氧氮杂  类化合物H的合成路线:
类化合物H的合成路线: 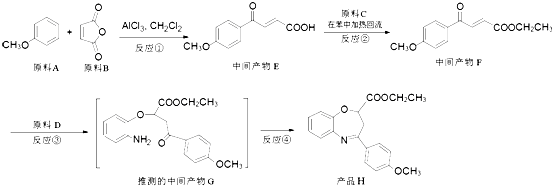 (1)、原料A的同分异构体中,含有苯环、且核磁共振氢谱中有4个峰的是(写出其结构简式).(2)、反应②的化学方程式是 .(3)、③的反应类型是 . 原料D中含有的官能团名称是、 .(4)、原料B俗名“马莱酐”,它是马莱酸(顺丁烯二酸:
(1)、原料A的同分异构体中,含有苯环、且核磁共振氢谱中有4个峰的是(写出其结构简式).(2)、反应②的化学方程式是 .(3)、③的反应类型是 . 原料D中含有的官能团名称是、 .(4)、原料B俗名“马莱酐”,它是马莱酸(顺丁烯二酸: )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( 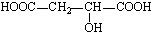 )和聚合物Q:
)和聚合物Q: 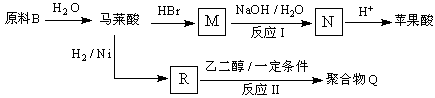
写出反应Ⅰ和反应Ⅱ的化学方程式:、 .
(5)、符合下列条件的中间产物F的同分异构体数目是(不考虑手性异构),写出其中任意一种的结构简式 .(i)能发生银镜反应;
(ii)分子中含有三取代的苯环结构,其中两个取代基是:﹣COOCH3和
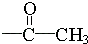 ,且二者处于对位.
,且二者处于对位.