2016年上海市黄浦区高考化学一模试卷
试卷更新日期:2016-08-18 类型:高考模拟
一、选择题
-
1. 屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,救了数千万人的生命,青蒿素分子结构如图.下列有关说法正确的是( )
 A、青蒿素可溶于乙醚和水 B、青蒿素的晶体为分子晶体,化学式为C16H20O5 C、青蒿素与NaOH溶液不反应 D、青蒿素含有过氧键,一定条件下有氧化性2. 下列有关物质的性质和应用都正确的是( )A、MgO、Al2O3熔点高,都可用于制作耐火材料 B、氨气显碱性,可用碱石灰或无水CaCl2干燥 C、氢氟酸具有强酸性,可用于雕刻玻璃 D、铜的活动性比铁弱,可在海轮外壳上装铜块以减缓海轮腐蚀3. 下列装置用于实验室制取氨气并检验氨气的某一化学性质,其中能达到实验目的是( )A、
A、青蒿素可溶于乙醚和水 B、青蒿素的晶体为分子晶体,化学式为C16H20O5 C、青蒿素与NaOH溶液不反应 D、青蒿素含有过氧键,一定条件下有氧化性2. 下列有关物质的性质和应用都正确的是( )A、MgO、Al2O3熔点高,都可用于制作耐火材料 B、氨气显碱性,可用碱石灰或无水CaCl2干燥 C、氢氟酸具有强酸性,可用于雕刻玻璃 D、铜的活动性比铁弱,可在海轮外壳上装铜块以减缓海轮腐蚀3. 下列装置用于实验室制取氨气并检验氨气的某一化学性质,其中能达到实验目的是( )A、 用装置图制取氨气
B、
用装置图制取氨气
B、 用装置图除去氨气中的水蒸气
C、
用装置图除去氨气中的水蒸气
C、 用装置图验证氨气具有还原性
D、
用装置图验证氨气具有还原性
D、 用装置图吸收氨气
4. 氮氧化铝(AlON)属于原子晶体,是一种超强透明材料,下列描述错的是( )A、AlON和石英的化学键类型相同 B、电解熔融AlON可得到Al C、AlON的N元素化合价为﹣1 D、AlON和石英晶体类型相同5. 亚氨基锂(Li2NH)是一种储氢容量高,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH.下列有关说法正确的是( )A、Li2NH中N的化合价是﹣1 B、该反应中H2既是氧化剂又是还原剂 C、Li+和H+的离子半径相等 D、此法储氢和钢瓶储氢的原理相同6. 胶头滴管在化学实验中是必不可少的一种实验物品,有关胶头滴管的说法错误的是( )A、主要是用来吸收或滴加少量试剂,以及吸取上层清液,分离沉淀 B、进行滴加的时候,胶头滴管要保持垂直在容器正上方 C、取液体时,先将胶头滴管伸入试剂瓶中,用手指捏紧滴管的胶头再放开手指 D、专用的胶头滴管在使用完之后,就一定要放回原试剂中7. 分类是化学研究常用的方法,下列物质分类正确的是( )
用装置图吸收氨气
4. 氮氧化铝(AlON)属于原子晶体,是一种超强透明材料,下列描述错的是( )A、AlON和石英的化学键类型相同 B、电解熔融AlON可得到Al C、AlON的N元素化合价为﹣1 D、AlON和石英晶体类型相同5. 亚氨基锂(Li2NH)是一种储氢容量高,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH.下列有关说法正确的是( )A、Li2NH中N的化合价是﹣1 B、该反应中H2既是氧化剂又是还原剂 C、Li+和H+的离子半径相等 D、此法储氢和钢瓶储氢的原理相同6. 胶头滴管在化学实验中是必不可少的一种实验物品,有关胶头滴管的说法错误的是( )A、主要是用来吸收或滴加少量试剂,以及吸取上层清液,分离沉淀 B、进行滴加的时候,胶头滴管要保持垂直在容器正上方 C、取液体时,先将胶头滴管伸入试剂瓶中,用手指捏紧滴管的胶头再放开手指 D、专用的胶头滴管在使用完之后,就一定要放回原试剂中7. 分类是化学研究常用的方法,下列物质分类正确的是( )选项
纯净物
酸性氧化物
碱性氧化物
酸
盐
A
碱石灰
二氧化硫
氧化铝
乙二酸
小苏打
B
五水硫酸铜
三氧化硫
氧化铜
油酸
苏打
C
过氧化氢
五氧化二磷
过氧化物
硬脂酸
碱式碳酸铜
D
盐酸
一氧化碳
氧化镁
冰醋酸
小苏打
A、A B、B C、C D、D8. 摩尔盐[(NH4)2Fe(SO4)2.6H2O,下列有关离子方程式错误的是( )A、通入足量的溴水:2Fe2++Br2=2Fe3++2Br﹣ B、先加盐酸在通入BaCl2溶液:SO +Ba2+=BaSO4↓ C、加氢氧化钠固体加热:NH +OH﹣=NH3↑+H2O D、检验该溶液是否变质:Fe3++3SCN﹣=Fe(SCN)39. 如图装置中,在U形管底部盛有CCl4 , 分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( ) A、铁丝在两处的腐蚀速率:a<b B、a、b两处相同的电极反应式为Fe﹣2e﹣=Fe2+ C、一段时间后,a处液面高于b处液面 D、生铁丝中的碳在a、b两处分别作原电池的负极和正极10. 海水开发利用的部分过程如图所示.下列说法错误的是( )
A、铁丝在两处的腐蚀速率:a<b B、a、b两处相同的电极反应式为Fe﹣2e﹣=Fe2+ C、一段时间后,a处液面高于b处液面 D、生铁丝中的碳在a、b两处分别作原电池的负极和正极10. 海水开发利用的部分过程如图所示.下列说法错误的是( ) A、向苦卤中通入Cl2是为了提取溴 B、粗盐可采用除杂和重结晶等过程提纯 C、工业生产常选用NaOH作为沉淀剂 D、富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收11. 利用下列装置进行相应实验,有关说法不正确的是( )
A、向苦卤中通入Cl2是为了提取溴 B、粗盐可采用除杂和重结晶等过程提纯 C、工业生产常选用NaOH作为沉淀剂 D、富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收11. 利用下列装置进行相应实验,有关说法不正确的是( ) A、图①装置可验证酸性:H2CO3>H2SiO3 B、图②装置可用于收集气体H2 CO2 Cl2 NH3 C、图③装置可用于分离CCl4萃取碘水后的有机层和水层 D、图④装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出12. 工业上,将氨气和空气的混合气体通过灼热铂﹣铑合金网,发生氨氧化反应.若有标准状况下aL氨气完全反应,并转移了b个电子,则阿伏加德罗常数NA的数值可表示为( )A、 B、 C、 D、13. 下列物质的转化在给定条件下能实现的是( )
A、图①装置可验证酸性:H2CO3>H2SiO3 B、图②装置可用于收集气体H2 CO2 Cl2 NH3 C、图③装置可用于分离CCl4萃取碘水后的有机层和水层 D、图④装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出12. 工业上,将氨气和空气的混合气体通过灼热铂﹣铑合金网,发生氨氧化反应.若有标准状况下aL氨气完全反应,并转移了b个电子,则阿伏加德罗常数NA的数值可表示为( )A、 B、 C、 D、13. 下列物质的转化在给定条件下能实现的是( )①NaAlO2(aq) AlCl3 Al
②NH3 NO HNO3
③NaCl(饱和) NaHCO3 Na2CO3
④FeS2 SO3 H2SO4 .
A、②③ B、①④ C、②④ D、③④14. 反应A(g)+B(g)⇌C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( ) A、该反应是放热反应 B、加入催化剂后,反应加快,△E减小 C、反应物的总键能大于生成物的总键能 D、反应达到平衡时,升高温度,A的转化率增大15. 下列各组离子中,在给定条件下能大量共存的是( )A、通入足量的二氧化碳后的溶液中Na+、 B、无色溶液中 C、酸性溶液中可能大量存在 D、=1012的溶液中 - 、Al3+、16. 25℃时,溶液均为0.1mol/L的溶液,其pH如表所示,下列有关说法正确的是( )
A、该反应是放热反应 B、加入催化剂后,反应加快,△E减小 C、反应物的总键能大于生成物的总键能 D、反应达到平衡时,升高温度,A的转化率增大15. 下列各组离子中,在给定条件下能大量共存的是( )A、通入足量的二氧化碳后的溶液中Na+、 B、无色溶液中 C、酸性溶液中可能大量存在 D、=1012的溶液中 - 、Al3+、16. 25℃时,溶液均为0.1mol/L的溶液,其pH如表所示,下列有关说法正确的是( )序号
①
②
③
④
溶液
NaCl
CH4COONH4
NaF
NaHCO3
pH
7.0
7.0
8.1
8.4
A、酸性强弱:H2CO3>HF B、①和②中溶质均未水解 C、离子的总浓度:①>③ D、④中:c(HCO )+2c(CO )+c(H2CO3)=0.1mol/L17. SF6是一种优良的绝缘气体,分子结构中存在S﹣F键.已知1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF﹣F.S﹣F键需吸收的能量分别为160kJ、330kJ.则发生反应S(s)+3F2(g)═SF6(g),产生1molSF6反应能量变化为( )A、释放1780KJ B、释放1220kJ C、释放450kJ D、吸收430kJ•mol﹣118. 下列有关溶液中粒子浓度的关系式正确的是( )A、25℃,0.1mol/L pH=4.5 的NaHC2O4溶液 c(HC2O )>c(C2O )>c(H2C2O4) B、向0.2mol/L的NaHCO3溶液中加入等体积的0.1mol/L的NaOH溶液c(H+)+c(Na+)=c(OH﹣)+c(CO )+c(HCO3﹣) C、常温下,氯化铵和氨水的混合溶液其pH=7,c(Cl﹣)=0.1mol/L c(Cl﹣)>c(NH4+)>c(OH﹣)=c(H+) D、浓度均为0.1mol/L的醋酸钠和醋酸的混合溶液中c(CH3COO﹣)﹣c(CH3COOH)=2[c(H+)﹣c(OH﹣)]19. 下列实验方案中,不能达到实验目的是( )选项
实验目的
实验方案
A
检验CH3CH2Br在NaOH溶液中是否发生水解
将CH3CH2Br与NaOH溶液共热.冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀
B
检验Fe(NO3)2晶体是否已氧化变质
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
C
验证Br2的氧化性强于I2
将少量溴水加入KI溶液中,再加入CCl4 , 振荡,静置.可观察到下层液体呈紫色
D
验证Fe(OH)3的溶解度小于Mg(OH)2
将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
A、A B、B C、C D、D20. FeCl3(aq)与KSCN(aq)混合时平衡:Fe3+(aq)+SCN﹣(aq)⇌Fe(SCN)2+(aq);已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T三关系如图所示,则下列说法正确的是( ) A、FeCl3(aq)与KSCN(aq)反应是放热反应 B、温度为T1、T2时,反应的平衡常数分别为K1、K2 , 则K1<K2 C、反应处于D点时,一定有V正>V逆 D、A点与B点相比,A点的c(Fe3+)大21. 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+ . 现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
A、FeCl3(aq)与KSCN(aq)反应是放热反应 B、温度为T1、T2时,反应的平衡常数分别为K1、K2 , 则K1<K2 C、反应处于D点时,一定有V正>V逆 D、A点与B点相比,A点的c(Fe3+)大21. 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+ . 现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( ) A、开始加入的K2Cr2O7为0.45mol B、图中AB段的氧化剂为K2Cr2O7 C、图中BC段发生的反应为Fe3++2I﹣→Fe2++I2 D、K2Cr2O7可与FeSO4反应的物质的量为3:122. 1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况).向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )A、该浓硝酸中HNO3的物质的量浓度是12.0 mol/L B、该合金中铜与镁的物质的量之比是2:1 C、NO2和N2O4的混合气体中,N2O4的体积分数是20% D、得到2.54g沉淀时,加入NaOH溶液的体积是6.0 mL
A、开始加入的K2Cr2O7为0.45mol B、图中AB段的氧化剂为K2Cr2O7 C、图中BC段发生的反应为Fe3++2I﹣→Fe2++I2 D、K2Cr2O7可与FeSO4反应的物质的量为3:122. 1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况).向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )A、该浓硝酸中HNO3的物质的量浓度是12.0 mol/L B、该合金中铜与镁的物质的量之比是2:1 C、NO2和N2O4的混合气体中,N2O4的体积分数是20% D、得到2.54g沉淀时,加入NaOH溶液的体积是6.0 mL二、解答题
-
23. 氢能是一种极具发展潜力的清洁能源.以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图所示:
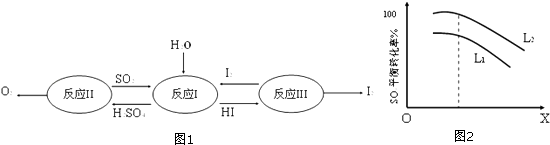
完成下列填空
(1)、反应Ⅰ的化学方程式是 .反应Ⅰ得到的产物用I2进行分离.该产物的溶液在过量I2的存在下会分成两层﹣﹣含低浓度I2的H2SO4层和高浓度的I2的HI层.
(2)、根据上述事实,下列说法正确的是(选填序号).a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
(3)、辨别两层溶液的方法: ,(4)、经检测,H2SO4层中c(H+):c(SO )=2.06:1.其比值大于2的原因是 .反应Ⅱ:2H2SO4(l)→2SO2(g)+O2(g)+2H2O(g)﹣1100kJ 它由两步反应组成:
i.H2SO4(l)→SO3(g)+H2O(g)﹣177kJ ii.SO3(g)分解.
L(L1、L2),X可分别代表压强或温度.图2表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系.
(5)、X代表的物理量是 , 推断的依据是 .(6)、判断L1和L2的大小,并简述理由 .24. A、B、C、D为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成一种极易溶于水的酸性气体Y.X分子与B2A分子中的电子数相同,Y分子中的电子数为18,A、B、D形成离子化合物B4A3D2 , 其水溶液呈弱酸性.完成下列填空
(1)、A元素的不同原子有;B原子的核外电子占据了个轨道(2)、C原子核外最外层的电子排布式 , C2和过量X反应的化学方程式 , 每生成1mol单质,转移的电子物质的量为 mol(3)、D2的化学性质稳定,原因是(4)、组成为的物质B4A3D2中所含的化学键有 , 其水溶液中各离子浓度大小顺序为(5)、液态X能自身电离,其阴离子电子式为 .25. 某化学小组利用如图装置进行某些气体的制备和性质实验,图中加持装置有省略 (1)、为制取干燥氨气,可将装置C与装置D连接,则装置D中 的固体宜选用
(1)、为制取干燥氨气,可将装置C与装置D连接,则装置D中 的固体宜选用a.碱石灰 b.无水氯化钙 c.五氧化二磷 d.生石灰
(2)、装置A、E、E连接可制取纯净干燥的氯气,则两个E装置内的药品依次是(3)、装置F可用于探究氯气和氨气反应,实验室打开开关1、3,关闭2,先向烧瓶中通入 , 然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体.实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子 .(4)、利用装置A、E,可设计实验比较氯离子和溴离子的还原性强弱,能证明结论的实验现象是 . 若利用装置A、E进行乙烯与溴水反应的实验,必须对装置A进行的改动是 .(5)、将装置B、C分别于F相连后,进行硫化氢和二氧化硫反应的实验,烧杯中的试剂所起的作用是 .26. 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:已知:①SO2(g)+Cl2(g)⇌SO2Cl2(l)+Q(Q>0)
②硫酰氯常温下为无色液体,熔点为﹣54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气.
 (1)、仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是 .(2)、装置C中干燥管里碱石灰作用是 . 装置E为储气装置,用于提供氯气,当装置E中排出氯气1.12L(已折算成标准状况)时,最终得到5.4g纯净的硫酰氯,则硫酰氯的产率为 . 为提高硫酰氯的产率,本实验操作中还需要注意的事项有(3)、反应结束后,将C装置中三颈烧瓶里的混合物分开的实验操作是 , 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式(4)、若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应. .27. 聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域具有广泛应用.如图是利用乙酰丙酸
(1)、仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是 .(2)、装置C中干燥管里碱石灰作用是 . 装置E为储气装置,用于提供氯气,当装置E中排出氯气1.12L(已折算成标准状况)时,最终得到5.4g纯净的硫酰氯,则硫酰氯的产率为 . 为提高硫酰氯的产率,本实验操作中还需要注意的事项有(3)、反应结束后,将C装置中三颈烧瓶里的混合物分开的实验操作是 , 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式(4)、若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应. .27. 聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域具有广泛应用.如图是利用乙酰丙酸 合成聚芳酯E的路线:
合成聚芳酯E的路线: 
已知:
 (1)、乙酰丙酸中含有的官能团是羰基和(填官能团名称).(2)、D的结构简式为 .(3)、下列关于有机物B的说法错误的是
(1)、乙酰丙酸中含有的官能团是羰基和(填官能团名称).(2)、D的结构简式为 .(3)、下列关于有机物B的说法错误的是a.能发生取代反应 b.能与浓溴水反应c.能发生消去反应 d.能与H2发生加成反应
(4)、A→B的化学方程式为 .(5)、C的分子式为 , F是符合下列条件的C的同分异构体①能发生银镜反应 ②能与NaHCO3溶液反应
③分子中有四种化学环境不同的氢原子 ④苯环上只有2个取代基,无
 结构
结构写出其中任一种与足量NaOH溶液共热反应的化学方程式: .
28. 喹硫平可用于精神疾病的治疗,它的合成路线如下: (1)、A属于烃,相对分子式量为54,A的结构简式为(2)、反应①﹣﹣⑤中属于取代反应的有 , 反应⑦的化学方程式为(3)、流程中设计反应⑤和⑦的目的是(4)、物质C的同分异构体中,既含有羟基,又含有醛基的同分异构体有种(5)、已知:苯环上的羧基为间位定位基,如
(1)、A属于烃,相对分子式量为54,A的结构简式为(2)、反应①﹣﹣⑤中属于取代反应的有 , 反应⑦的化学方程式为(3)、流程中设计反应⑤和⑦的目的是(4)、物质C的同分异构体中,既含有羟基,又含有醛基的同分异构体有种(5)、已知:苯环上的羧基为间位定位基,如 写出以甲苯为原料制备
写出以甲苯为原料制备  的合成路线 . 29. 硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~900℃时,硫铁矿在氧气中煅烧,可能发生下列反应(假设空气中的N2和O2体积比为4:1)
的合成路线 . 29. 硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~900℃时,硫铁矿在氧气中煅烧,可能发生下列反应(假设空气中的N2和O2体积比为4:1)①3FeS2+8O2→Fe3O4+6SO2 ②4FeS2+11O2→2Fe2O3+8SO2
(1)、含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为 .(2)、某硫酸厂每天用含FeS260%的硫铁矿500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2的转化率为90%.每天能生产98%的硫酸吨(3)、硫铁矿煅烧过程中空气用量不同时,发生反应和生成炉气中SO2含量也不同,含FeS2 72%的硫铁矿在空气中煅烧并按反应①完全反应,列式计算炉气中的SO2的体积分数最大为多少?(4)、为确保SO2转化为SO3的转化率,某硫酸厂使用富氧空气(空气中加纯氧)煅烧硫铁矿,炉气中SO2和O2的体积分数分别达到11%和9%,FeS2完全转化为Fe2O3 , 列式计算富氧空气中的氧气体积分数为多少?