2016年江西省宜春市樟树市高考化学四模试卷
试卷更新日期:2016-08-18 类型:高考模拟
一、选择题
-
1. 下列关于可逆反应的说法中正确的是( )A、可逆反应就是既能向正反应方向进行,又能向逆反应方向进行的化学反应 B、在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫又分解生成二氧化硫和氧气,因此该反应是可逆反应 C、对于合成氨的反应,如果调控好反应条件,可使一种反应物的转化率达到100% D、碳酸钙在高温下分解生成氧化钙和二氧化碳,氧化钙和二氧化碳在常温下生成碳酸钙,因此这两个反应是可逆反应2. 用98%的浓H2SO4(密度为1.84g/mL)配制1mol•L﹣1的稀H2SO4 100mL,配制过程中可能用到下列仪器:①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶; ⑥胶头滴管;⑦玻璃棒.按使用出现的先后顺序排列正确的是( )A、②⑥③⑦⑤ B、④③⑤⑦⑥ C、①③⑦⑤⑥ D、②⑤⑦⑥3. X和Y元素的原子在化学反应中都容易失去电子,形成与Ne原子具有相同电子层结构的离子,且X的原子序数大于Y的原子序数.下列说法正确的是( )A、X的金属性比Y的强 B、X的最高正化合价比Y 的高 C、常温下,X和Y的单质一定不与水反应 D、Y的最高价氧化物对应水化物的碱性比X的弱4. 下列离子方程式正确的是( )A、硫酸铝溶液中加入过量氨水:Al3++3OH﹣═Al(OH)3↓ B、向明矾溶液中滴加Ba(OH)2溶液至Al3+刚好沉淀完全:2Al3++3SO42﹣+3Ba2++6OH﹣═3BaSO4↓+2Al(OH)3↓ C、NH4HCO3溶于过量的NaOH溶液中:HCO +OH﹣═CO +H2O D、稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑5. 云南特色小吃“过桥米线”做法如下:先用滚沸的鸡汤一碗,上罩浮油,再辅以切得极薄的生肉片、乌龟片、火腿片、葱头等,最后把主料米线放入拌食即成.“过桥米线”汤鲜、肉嫩、料香、米线滑润,吃起来别有一番风味.以下有关“过桥米线”的说法不正确的是( )A、上层浮油沸点较高,难以挥发 B、浮油对下层汤水起到很好的“液封”作用,使下层汤水及热量难以外逸 C、去掉上面的一层浮油,将减弱“过桥米线”的保温效果 D、上层浮油高温水解即产生美味的物质6. 由钠、镁、铝、锌4种金属单质中的两种组成的合金共48 g,跟足量的盐酸反应产生22.4 L氢气(标准状况),那么此合金中一定含有的金属是( )A、Na B、Mg C、Al D、Zn7. 将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO,N2O4 , NO2)的混合物共0.8mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,生成的盐溶液中NaNO3的物质的量为(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO+NO2+2NaOH=2NaNO2+H2O.)( )A、0.2 mol B、0.4 mol C、0.6 mol D、0.8 mol8. 相同温度下,体积均为0.25 L 的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.6 kJ/mol.实验测得起始、平衡时数据如下表( )
容器编号
起始时各物质物质的量/mol
达平衡时体系能量的变化
N2
H2
NH3
①
1
3
0
放出热量:23.15kJ
②
0.8
2.4
0.4
放出热量:Q
A、容器①、②中反应的平衡常数相等,平衡时氮气的转化率相等 B、平衡时,两个容器中NH3 的体积分数均为1/8 C、容器②中达平衡时放出的热量Q=4.63 kJ D、若容器①改为恒压体系,充入0.25 L He,则平衡时放出的热量大于23.15 kJ二、解答题
-
9. 四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
W
X
Y
Z
结构或性质
最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物
焰色反应呈黄色
在同周期主族元素形成的简单离子中,离子半径最小
最高正价与最低负价之和为零
(1)、Z在元素周期表中位于族.(2)、上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是(填元素符号).(3)、①下列可作为比较X和Y金属性强弱的依据是(填序号).a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因: .
(4)、W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是 , 混合后溶液中离子浓度由大到小的顺序是 .(5)、Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.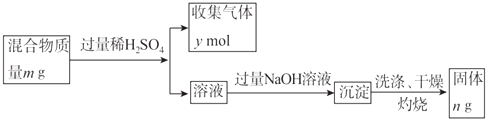
能确定混合物中Y的质量分数的数据有(填序号).
a.m、n b.m、y c.n、y.
10. 如图是Na2O2和CO2定性、定量实验的装置示意图.
注射器1中抽取了100 mL CO2 , U型管中装有适量小玻璃珠和约1.5 gNa2O2粉末.实验开始时,打开K1、K2、K4止水夹,关闭K3止水夹,推动注射器1活塞,缓缓将CO2压至U形管,注射器2活塞缓缓向外移动.回答下列问题:(本题不考虑注射器内壁的摩擦阻力)
(1)、U形管内的玻璃珠并不参与反应,其所起的作用除防止过氧化钠粉末被吹走外,另一个重要作用是 .(2)、U形管中可观察到的反应现象是 .(3)、注射器1活塞推到底后,注射器2中收集到的气体大于50 mL,其原因除可能仍还含CO2外,还有一个重要原因是 .(4)、为了使剩余气体中二氧化碳能反应完,接下来的操作是 .(5)、要证明反应产物之一为氧气,最为方便的实验方法是 .(6)、本实验结束后固体产物板结,难以从U型管中取出,为了要证明固体产物中含有碳酸盐,实验时还需要从如图所示仪器和试剂中选择(填字母).当装置和药品都安装完毕后,接下来的操作步骤是 . 11. 平达喜是一种常用抗酸药,其主要成分是由短周期元素组成的化合物X,式量为602.甲同学欲探究X的组成.
11. 平达喜是一种常用抗酸药,其主要成分是由短周期元素组成的化合物X,式量为602.甲同学欲探究X的组成.查阅资料:
①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、碱式碳酸镁铝(或结晶水合物).
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.
实验过程:
Ⅰ.向一定量的X粉末中加入45.0 mL的2mol/L盐酸溶液中,恰好完全反应并收集到112 mL(标准状况下)的A气体,A气体可使澄清石灰水变浑浊.
Ⅱ.用铂丝蘸取少量Ⅰ中所得的溶液,在火焰上灼烧,无黄色火焰.
Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.沉淀物进行洗涤干燥后重1.74 g.
(1)、A的电子式是 .(2)、由Ⅰ中可确定X中存在两种带负电荷的原子团及个数比 .(3)、由Ⅰ判断X一定不含有的元素是 .(4)、Ⅲ中生成B的离子方程式是 .(5)、Ⅳ中B溶解的化学方程式是 .(6)、沉淀C的化学式是 .(7)、若X中n(B):n(C)=1:3,则X的化学式是 .12. 6﹣APA( ) 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如下:
) 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如下: 
已知:
 (1)、F中含氧官能团的名称是羟基、 .(2)、①、⑤的反应类型分别是、 .(3)、D的结构简式是 .(4)、反应④的化学方程式是 .(5)、反应①的目的是 .(6)、芳香族化合物G是E的同分异构体.G分子满足下列条件:
(1)、F中含氧官能团的名称是羟基、 .(2)、①、⑤的反应类型分别是、 .(3)、D的结构简式是 .(4)、反应④的化学方程式是 .(5)、反应①的目的是 .(6)、芳香族化合物G是E的同分异构体.G分子满足下列条件:a.苯环上的一溴代物只有一种;
b.核磁共振氢谱显示有四种不同化学环境的氢;
c.能发生水解反应且产物之一的分子式是C7H8O3 .
写出所有符合上述条件的G的结构简式: .