2015年广西柳州市柳铁一中高考化学模拟试卷(8)
试卷更新日期:2016-08-18 类型:高考模拟
一、选择题
-
1. 化学与社会、生活及生产关系密切.对下列有关现象或事实的解释说明正确的是( )
选项
现象或事实
解释与说明
A
苹果放在空气中久置变黄和纸张久置变黄
二者变黄的原理相似
B
用四氯化碳进行衣服的干洗
目的是节约用水
C
钢铁制品和铜制品在空气中被腐蚀
二者既能发生吸氧腐蚀又能发生析氢腐蚀
D
形成黄河入海口沙洲、用卤水点豆腐
都体现了胶体聚沉的性质
A、A B、B C、C D、D2. 下列有关实验仪器的使用方法及实验操作正确的是( )A、蓝矾结晶水测定实验中,用坩埚钳取下坩埚放置在桌面上冷却 B、用试管夹夹持试管加热时,用手紧紧握住试管夹的长柄和短柄 C、测定中和反应的反应热时,将NaOH溶液一次性倒入盐酸中,并用环形玻璃搅拌棒搅动溶液 D、实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取→蒸馏3. aX、bY、dZ、W是四种短周期主族元素(只有一种是金属),b﹣a=d﹣b=1,Z与W可形成两种常见的化合物,其中一种(Q)有强氧化性且在航天、潜水过程中有极为重要的用途,下列说法中正确的是( )A、Q中只有离子键 B、原子半径W>Z>Y>X C、Y元素可形成两种含氧酸,且这两种含氧酸均为强酸 D、最简单氢化物的稳定性Z>Y>X,沸点Z>Y>X4. 下列有关叙述不正确的是( )选项
已知
解释与结论
A
活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池
Al作正极,Cu作负极
B
4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)
该反应在常温下能自发进行
该反应的△H<0
C
常温下,Ksp(AgCl)=1.8×10﹣10、
Ksp(AgBr)=5.4×10﹣13
向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时, =3×10﹣3
D
向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色
氧化性:H2O2>Fe3+
A、A B、B C、C D、D5. 下列各离子组在溶液中能大量共存且通入括号中相应气体后,仍能大量共存的是( )A、NH 、Ca2+、HSO 、Cl﹣ (氨气) B、Ba2+、NO 、Na+、Cl﹣ (二氧化硫) C、Na+、K+、HCO 、Cl﹣ (二氧化碳) D、Al3+、SO 、HCO 、NO (氯化氢)6. 已知二甲苯有3种同分异构体,二甲苯中苯环上的一溴代物共有6种,其熔点见下表:6种一溴二甲苯的熔点/℃
234
206
213.8
204
214.5
205
对应二甲苯的熔点/℃
13
﹣54
﹣27
﹣54
﹣27
﹣54
由此推断熔点为234℃的一溴二甲苯可能是( )
A、 B、
B、 C、
C、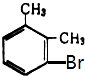 D、
D、 7. 下列坐标图均涉及到平衡原理,其中相关( )A、
7. 下列坐标图均涉及到平衡原理,其中相关( )A、 如图表示室温下,用0.1mol•L﹣1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3•H2O),虚线表示c(NH ),处于M点时溶液呈中性
B、
如图表示室温下,用0.1mol•L﹣1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3•H2O),虚线表示c(NH ),处于M点时溶液呈中性
B、 如图表示2SO2(g)+O2(g)⇌2SO3(g)△H<0,正逆反应的平衡常数随温度的变化
C、
如图表示2SO2(g)+O2(g)⇌2SO3(g)△H<0,正逆反应的平衡常数随温度的变化
C、 如图表示反应2NH3(g)⇌3H2(g)+N2(g),在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
D、
如图表示反应2NH3(g)⇌3H2(g)+N2(g),在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
D、 如图表示AgCl(s)⇌Ag+(aq)+Cl﹣(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
如图表示AgCl(s)⇌Ag+(aq)+Cl﹣(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
二、非选择题
-
8. 在平板电视显示屏生产过程中产生的大量废玻璃粉末中含有二氧化铈(CeO2).(1)、①煅烧Ce(OH)CO3可制备CeO2 , 配平该反应的化学方程式
Ce(OH)CO3+O2=CeO2+CO2+H2O
②已知在一定条件下,电解熔融状态的CeO2可制备Ce,在阴极获得铈,写出阴极的电极反应式;
(2)、某课题组以上述废玻璃粉末(含有SiO2、Fe2O3、CeO2以及其他少量不溶于稀酸的物质)为原料,设计如图1流程对资源进行回收,得到Ce(OH)4和硫酸铁铵.
①得到滤渣B时,需要将其表面杂质洗涤干净.检验滤渣B已经洗涤干净的方法是 .
②反应①的离子方程式为 .
③如图2,氧化还原滴定法测定制得的Ce(OH)4产品的纯度.
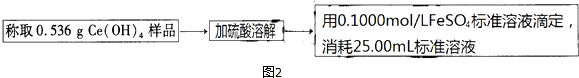
该产品中Ce(OH)4的质量分数为(保留小数点后两位).若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度(“偏高”、“偏低”或“无影响”).
(3)、操作I的名称是 .9. 根据所学知识,完成下面题目:(1)、亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应获得:NO(g)+Cl2(g)═2ClNO(g).①氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g)△H1 K1
4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
2NO(g)+Cl2(g)⇌2ClNO(g)△H3 K3
则△H3=(用△H1和△H2表示),K3=(用K1和K2表示).
②NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O.室温下,用一定量的NaOH
溶液吸收NO、NO2混合气体,得到0.1mol/L的NaNO2溶液.已知HNO2的电离常数Ka=7.1×10﹣4 ,
那么室温下NO2﹣的水解常数Kh= , 0.1mol/L NaNO2溶液中从c(Na+ )、c(OH﹣ )、c(NO2﹣ )、c(HNO2)的大小顺序为 .
(2)、在3.0L密闭容器中,通入0.10mol CH4和0.20molNO2 , 在一定温度下进行反应,CH4(g)+2NO2(g)⇌CO2(g)+N2(g)+2H2O(g)△H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:时间t/min
0
2
4
6
8
10
总压强p/100kPa
4.80
5.44
5.76
5.92
6.00
6.00
①由表中数据计算0~4min内v(NO2)= , 该温度下的平衡常数K=(不必带单位).
②在一恒容装置中,通入一定量CH4和NO2 , 测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):

则下列叙述正确的是 .
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v (逆)>e点的 v (逆)
C.平衡常数:c点=d点
D.提高b点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
10. 1﹣苯乙醇具有柔和、愉快而持久的玫瑰香气,广泛用于各种食用香精和烟用香精中.实验室以苯乙酮和硼氢化钠为原料制备1﹣苯乙醇的反应原理(图1)、装置(图2)和有关数据如表:试剂
熔点(℃)
沸点(℃)
密度(g•cm﹣3)
溶解性
水
乙醇
乙醚
1﹣苯乙醇
20
203.4
1.013
不溶
溶
溶
苯乙酮
19.7
202.3
1.028
不溶
溶
溶
硼氢化钠
﹣
﹣
1.076
溶
溶
不溶
乙醚
﹣116.3
34.6
0.713
微溶
溶
﹣

实验步骤:①在烧杯中加入15mL 95%的乙醇和0.1g硼氢化钠,搅拌下,再滴入8mL苯乙酮,控制温
度在48℃~50℃,滴加完毕,室温下放置15min.
②在搅拌的条件下,慢慢滴加6mL 3mol/L的盐酸.
③水浴加热,使反应液中大部分乙醇蒸出,出现分层,再加入10mL乙醚.将混合反应液倒入分液漏
斗,分离上述液体,水层再用10mL乙醚萃取,合并两次分液得到的有机相.
④加入适量无水硫酸镁,静置片刻,过滤除去硫酸镁固体.再加入0.6g无水碳酸钾,然后进行简单蒸
馏除去乙醚.
⑤经减压蒸馏得到1﹣苯乙醇4.5g(减压蒸馏可降低有机物的沸点).
(1)、反应中加入乙醇的目的是 .(2)、反应完成后,蒸出大部分乙醇,反应液出现分层,上层为(填“水层”或“有机层”,下同),加入10mL乙醚,充分振荡后,上层为 .(3)、装置中仪器A的名称为 , 在本实验中最好选用的规格是(填“50mL”、“100mL”或“200mL”);仪器B中冷凝水由(填“a”或“b”)口流出.(4)、步骤④中加入无水硫酸镁的作用是 .(5)、步骤④蒸馏除去乙醚时,应采用的最佳加热方式为(填字母序号)a.酒精灯加热 b.水浴加热 c.油浴加热 d.酒精喷灯加热.
11. 在研究金矿床物质组分的过程中,通过分析发现了Cu﹣Ni﹣Zn﹣Sn﹣Fe多金属互化物.(1)、某金属互化物属于晶体,区别晶体和非晶体可通过方法鉴别.该金属互化物原子在三维空间里呈周期性有序排列,即晶体具有性.(2)、基态Ni2+的核外电子排布式;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4 属于晶体.(3)、铜能与类卤素(SCN)2反应生成Cu(SCN)2.1mol(SCN)2分子中含有σ键的数目为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N=C=S)的沸点,其原因是;(4)、立方NiO(氧化镍)晶体的结构如图﹣1所示,其晶胞边长为apm,列式表示NiO晶体的密度为 g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)人工制备的NiO晶体中常存在缺陷(如图﹣2)一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为 .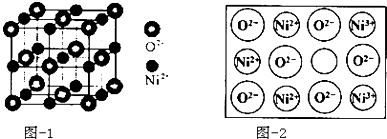 12. 5﹣氯﹣2,3﹣二氢﹣1﹣茚酮是一种重要的医药中间体.
12. 5﹣氯﹣2,3﹣二氢﹣1﹣茚酮是一种重要的医药中间体.已知:R﹣Cl RCH(COOC2H5)2
 RCH2COOH
RCH2COOH以化合物A(分子式为C7H7Cl)为原料合成5﹣氯﹣2,3﹣二氢﹣1﹣茚酮(化合物F)工艺流程如下:
A B

 D
D 
 (1)、写出A结构简式 , 反应E→F的反应类型 .(2)、化合物B中加入足量的氢氧化钠水溶液,在高温高压的条件并加合适的催化剂(所有卤素原子参与水解)反应的方程式 .(3)、某化合物是D的同分异构体,能使FeCl3溶液显紫色,且分子中只有3种不同化学环境的氢.写出该化合物的结构简式:(任写一种).(4)、E→F的转化中,会产生一种与F互为同分异构体的副产物,其结构简式为 .(5)、根据已有知识并结合相关信息,写出以化合物F和CH2(COOC2H5)2为有机反应原料制备
(1)、写出A结构简式 , 反应E→F的反应类型 .(2)、化合物B中加入足量的氢氧化钠水溶液,在高温高压的条件并加合适的催化剂(所有卤素原子参与水解)反应的方程式 .(3)、某化合物是D的同分异构体,能使FeCl3溶液显紫色,且分子中只有3种不同化学环境的氢.写出该化合物的结构简式:(任写一种).(4)、E→F的转化中,会产生一种与F互为同分异构体的副产物,其结构简式为 .(5)、根据已有知识并结合相关信息,写出以化合物F和CH2(COOC2H5)2为有机反应原料制备 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: CH3CH2OH CH2=CH2
