江苏省南京市秦淮区2016-2017学年九年级下学期化学一模考试试卷
试卷更新日期:2017-11-08 类型:中考模拟
一、选择题
-
1. 下列过程中,只发生物理变化的是( )A、粮食酿酒 B、棉纱织布 C、火药爆炸 D、乙醇燃烧2. 下列图示实验操作中,正确的是( )A、
 B、
B、 C、
C、 D、
D、 3. 空气的成分按体积计算,约占0.03%的是( )A、氮气 B、氧气 C、二氧化碳 D、稀有气体4. 下列物质中,不属于某种基本营养素的是( )A、水 B、维生素C C、淀粉 D、甲醛5. 有些共享单车非常轻便,其车身主要是航空铝合金材质。铝合金属于( )A、合成材料 B、金属材料 C、天然材料 D、复合材料6. 下列物质中,可用作复合肥料的是( )A、KNO3 B、CO(NH2)2 C、K2SO4 D、Ca3(PO4)27. 一阵风吹熄蜡烛,其主要的灭火原理是( )A、隔绝空气 B、清除可燃物 C、降低石蜡的着火点 D、使温度降到石蜡的着火点以下8. 溴元素的原子结构示意图和其在周期表中的某些信息如图所示。下列说法不正确的是( )
3. 空气的成分按体积计算,约占0.03%的是( )A、氮气 B、氧气 C、二氧化碳 D、稀有气体4. 下列物质中,不属于某种基本营养素的是( )A、水 B、维生素C C、淀粉 D、甲醛5. 有些共享单车非常轻便,其车身主要是航空铝合金材质。铝合金属于( )A、合成材料 B、金属材料 C、天然材料 D、复合材料6. 下列物质中,可用作复合肥料的是( )A、KNO3 B、CO(NH2)2 C、K2SO4 D、Ca3(PO4)27. 一阵风吹熄蜡烛,其主要的灭火原理是( )A、隔绝空气 B、清除可燃物 C、降低石蜡的着火点 D、使温度降到石蜡的着火点以下8. 溴元素的原子结构示意图和其在周期表中的某些信息如图所示。下列说法不正确的是( ) A、溴元素为非金属元素 B、溴元素的原子结构示意图中,n=5 C、溴元素的相对原子质量为79.90 D、溴元素在周期表中位于第四周期9. 下列说法不正确的是( )A、用熟石灰检验铵态氮肥 B、用水区分硝酸铵和氢氧化钠 C、用氢氧化钠溶液制作“叶脉书签” D、用铁制容器配制农药波尔多液10. 枯茗醛(化学式为C10H12O)是一种食用香料。下列有关枯茗醛的说法中,正确的是( )A、枯茗醛属于有机高分子化合物 B、枯茗醛中氧元素的质量分数最小 C、枯茗醛中碳、氢元素的质量比为10:1 D、枯茗醛由10个碳原子、12个氢原子和1个氧原子构成11. 下列各组离子在水中能大量共存的是( )A、Mg2+、NH4+、NO3-、SO42- B、H+、Na+、HCO3-、Cl- C、Ba2+、Ag+、Cl-、CO32- D、Fe3+、K+、NO3-、OH-12. 下列有关实验的叙述中,正确的是( )A、验证氧气的性质时,把红热的木炭插入盛有氧气的集气瓶,要由瓶口向下快速插入 B、把1~2小粒碘分别投入5mL水、5mL汽油中,振荡,观察到碘几乎不溶于汽油 C、把等量的肥皂水分别滴加到等量的软水、硬水中,振荡,观察到软水中产生较多泡沫 D、把乒乓球碎片和滤纸碎片分开放在一块薄铜片的两侧,加热铜片的中部,滤纸先燃烧13. 下表是NaCl、KNO3在不同温度时的溶解度:
A、溴元素为非金属元素 B、溴元素的原子结构示意图中,n=5 C、溴元素的相对原子质量为79.90 D、溴元素在周期表中位于第四周期9. 下列说法不正确的是( )A、用熟石灰检验铵态氮肥 B、用水区分硝酸铵和氢氧化钠 C、用氢氧化钠溶液制作“叶脉书签” D、用铁制容器配制农药波尔多液10. 枯茗醛(化学式为C10H12O)是一种食用香料。下列有关枯茗醛的说法中,正确的是( )A、枯茗醛属于有机高分子化合物 B、枯茗醛中氧元素的质量分数最小 C、枯茗醛中碳、氢元素的质量比为10:1 D、枯茗醛由10个碳原子、12个氢原子和1个氧原子构成11. 下列各组离子在水中能大量共存的是( )A、Mg2+、NH4+、NO3-、SO42- B、H+、Na+、HCO3-、Cl- C、Ba2+、Ag+、Cl-、CO32- D、Fe3+、K+、NO3-、OH-12. 下列有关实验的叙述中,正确的是( )A、验证氧气的性质时,把红热的木炭插入盛有氧气的集气瓶,要由瓶口向下快速插入 B、把1~2小粒碘分别投入5mL水、5mL汽油中,振荡,观察到碘几乎不溶于汽油 C、把等量的肥皂水分别滴加到等量的软水、硬水中,振荡,观察到软水中产生较多泡沫 D、把乒乓球碎片和滤纸碎片分开放在一块薄铜片的两侧,加热铜片的中部,滤纸先燃烧13. 下表是NaCl、KNO3在不同温度时的溶解度:
据此数据,下列说法正确的是( )
A、20℃时,将20g NaCl加入50g水中,得到70g溶液 B、50℃时,KNO3溶液的溶质质量分数大于NaCl溶液的溶质质量分数 C、降温时,KNO3溶液析出的固体质量大于NaCl溶液析出的固体质量 D、NaCl和KNO3的溶解度曲线在20℃~30℃之间相交14. 除去物质中的少量杂质,下列方法不能达到目的的是( )选项
物质
杂质
除去杂质的方法
A
CaO
CaCO3
高温充分煅烧
B
KCl溶液
CaCl2
通入足量的CO2 , 过滤
C
CO2
CO
通过足量的灼热氧化铜
D
H2
HCl
依次通过足量的NaOH溶液和浓硫酸
A、A B、B C、C D、D15. 在相同的温度和压强下,相同体积的气体具有相同的分子数,反之亦然。取20℃和101kPa下相同体积的CH4和O2混合,在一定条件下充分反应,恢复到初始温度和压强。下列说法正确的是( )A、参加反应的CH4和O2的体积比为1:1 B、生成的CO2分子个数为原来气体分子数的三分之一 C、反应后气体的体积为原来的二分之一 D、反应后的气体中C、O原子的个数比为1:2二、探究题
-
16. 根据下列装置图,回答有关问题:
 (1)、写出装置图中标号仪器的名称:① , ②;(2)、实验室用氯酸钾和二氧化锰制取氧气的化学方程式为;(3)、实验室制取二氧化碳的化学方程式为 , 可选用的收集装置为(填字母);(4)、检验装置B的气密性时,从长颈漏斗向锥形瓶中加水至浸没下端管口,用止水夹夹住橡皮管,继续加水至形成一段水柱,若 , 则装置B的气密性良好。17. 水的组成揭秘:(1)、【资料卡片】18世纪末,英国科学家普利斯特里把“易燃空气”(即氢气)和空气混合后盛在干燥、洁净的玻璃瓶中,当用电火花点火时,发出震耳的爆鸣声,且玻璃瓶内壁上出现了(写现象)。(2)、【定性实验】
(1)、写出装置图中标号仪器的名称:① , ②;(2)、实验室用氯酸钾和二氧化锰制取氧气的化学方程式为;(3)、实验室制取二氧化碳的化学方程式为 , 可选用的收集装置为(填字母);(4)、检验装置B的气密性时,从长颈漏斗向锥形瓶中加水至浸没下端管口,用止水夹夹住橡皮管,继续加水至形成一段水柱,若 , 则装置B的气密性良好。17. 水的组成揭秘:(1)、【资料卡片】18世纪末,英国科学家普利斯特里把“易燃空气”(即氢气)和空气混合后盛在干燥、洁净的玻璃瓶中,当用电火花点火时,发出震耳的爆鸣声,且玻璃瓶内壁上出现了(写现象)。(2)、【定性实验】如图所示,在电解器玻璃管里加满含有酚酞的硫酸钠溶液,接通直流电源,电解一段时间后,断开电源,用燃着的木条分别在两个玻璃管尖嘴口检验电解反应中产生的气体。
①检验管a中产生的气体时,观察到。
②该实验说明水是由组成的。
 (3)、本实验中,水中加入少量硫酸钠以增强导电性,硫酸钠不发生反应。
(3)、本实验中,水中加入少量硫酸钠以增强导电性,硫酸钠不发生反应。电解后,待溶液混合均匀,观察到溶液的颜色为无色,测定其pH=7。但在实验过程中,观察到管b电极附近的溶液迅速变红,则此时管a电极附近的溶液呈(填“酸”、“碱”或“中”)性。
(4)、【交流反思】若取24g质量分数为2%的硫酸钠溶液进行电解,消耗了4g水,则电解后的硫酸钠溶液的质量分数为。
(5)、本实验中,若水中加入少量氢氧化钠以增强导电性,氢氧化钠不发生反应,则电解后溶液的碱性(填“增强”、“减弱”或“不变”)。(6)、【定量实验】利用以下装置进行实验,分别称量反应前后玻璃管(含其中物质)的质量和U形管(含其中物质)的质量,可以进一步测定水中氢、氧元素的质量比。

①装置的正确连接顺序是(填字母,且每套装置限用一次)。
②下列情况中,有可能造成测定值大于理论值的是(填序号)。
①氧化铜未被完全还原;
②未连接装置B;
③装置C中U形管后未连接干燥管。
三、信息分析题
-
18. 日常生活中所说的盐,通常指食盐(主要成分是氯化钠)。(1)、氯化钠是由(写粒子符号)构成的;(2)、通过晾晒海水,可以蒸发除去水分,得到粗盐。通常不采用降低海水温度的方法得到粗盐,是因为 , 相同情况下降温析出的晶体比较少;(3)、根据“粗盐中难溶性杂质的去除”实验,回答有关问题:
①溶解:称取5.0g粗盐,逐渐加入10mL水中,直到不再溶解,剩余粗盐1.1g。
②过滤
③蒸发在加热过程中,用玻璃棒不断搅拌,防止。当蒸发皿中 , 停止加热。
④计算产率:得到精盐3.3g,则精盐的产率为(计算结果保留一位小数)。
(4)、若经过上述实验得到的精盐中还含有氯化镁、氯化钙,为了除去这两种可溶性杂质,可将得到的精盐全部溶于水,加入过量的氢氧化钠溶液和溶液,充分反应后,接下来的操作顺序是(填序号)。①蒸发 ②加入过量的稀盐酸 ③过滤
19. 图中A~I是初中化学常见的物质,且分别是由H、O、Na、Al、S、Cl、Cu、Ba中的一种或几种元素组成的。C为紫红色固体;E能与油脂反应,在生活中可用来去除油污;B、D、G、I为相同类别的化合物。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。 (1)、写出化学式E:。(2)、写出化学方程式:
(1)、写出化学式E:。(2)、写出化学方程式:A与B的反应;
H与F的反应;
G与I的反应。
四、简答题
-
20. 地球上的金属资源广泛地存在于地壳和海洋中。(1)、利用金属活泼性的不同,可以采用不同的冶炼方法。
冶炼方法
主要原理
代表金属
电解法
熔融的金属化合物在通电的条件下分解
钠、铝
热还原法
金属氧化物与一氧化碳(或碳等)在高温的条件下反应
铁、铜
热分解法
金属氧化物在加热的条件下分解
汞、银
利用金属活泼性的不同,可以采用不同的冶炼方法。
①电解熔融的氯化镁可以得到镁。分别写出氯化镁和镁的化学式,并标出其中镁元素的化合价:、。
②炼铁的原理是利用一氧化碳和氧化铁的反应,写出该反应的化学方程式:。
③二百多年前,拉瓦锡研究空气的成分时,加热红色的氧化汞粉末得到了银白色的汞,写出该反应的化学方程式:。
④从含有铅元素并有开采价值的矿石中提取铅,应选择上述方法中的。
(2)、某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8 t(硫酸的质量分数为20%),与足量的废铁屑反应,可生产硫酸亚铁的质量是多少?(写出计算过程)21. 硅(Si)是信息技术的关键材料,以石英砂(主要成分为SiO2)为原料制得纯硅的生产过程如下图所示: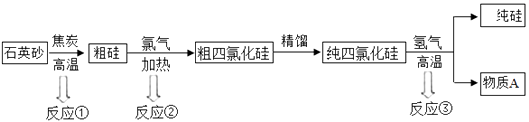 (1)、反应①中会排放出CO,CO极易与血液中的结合,从而使其不能再与氧气结合,造成生物体缺氧。(2)、反应②对应的化学方程式为。(3)、反应③所属基本反应类型为;物质A的水溶液可用来除铁锈,发生反应的化学方程式为。(4)、100 t含SiO2 90%的石英砂,理论上可生产纯硅的质量是。
(1)、反应①中会排放出CO,CO极易与血液中的结合,从而使其不能再与氧气结合,造成生物体缺氧。(2)、反应②对应的化学方程式为。(3)、反应③所属基本反应类型为;物质A的水溶液可用来除铁锈,发生反应的化学方程式为。(4)、100 t含SiO2 90%的石英砂,理论上可生产纯硅的质量是。