广西南宁、北海、钦州、防城港2017年中考化学试题
试卷更新日期:2017-11-07 类型:中考真卷
一、选择题
-
1. 下列不计入空气污染指数的项目是( )A、氧气 B、一氧化碳 C、二氧化氮 D、可吸入颗粒物2. 回收废弃塑料可以节约资源,减少“白色污染”,下列表示塑料包装制品回收标志的是( )A、
 B、
B、 C、
C、 D、
D、 3. 防治佝偻病和骨质疏松症需适量补充的元素是( )A、铁 B、锌 C、碘 D、钙4. 关于银的性质描述中,属于化学性质的是( )A、银是银白色的 B、银不易与氧气反应 C、银具有优良的导电性 D、银具有良好的延展性5. 下列有关燃烧、灭火的分析,错误的是( )
3. 防治佝偻病和骨质疏松症需适量补充的元素是( )A、铁 B、锌 C、碘 D、钙4. 关于银的性质描述中,属于化学性质的是( )A、银是银白色的 B、银不易与氧气反应 C、银具有优良的导电性 D、银具有良好的延展性5. 下列有关燃烧、灭火的分析,错误的是( )
A、火上浇油——增加可燃物 B、釜底抽薪——移走可燃物 C、吹灭蜡烛——降低着火点 D、油锅着火用锅盖盖灭——隔绝空气6. 下列实验操作中,正确的是( )A、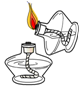 点燃酒精灯
B、
点燃酒精灯
B、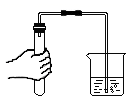 检查装置气密性
C、
检查装置气密性
C、 倾倒液体
D、
倾倒液体
D、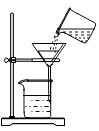 过滤
7. Cr2O3可以作为某些反应的催化剂,其中Cr元素的化合价是( )A、-3 B、+2 C、+3 D、+68. 下列说法中,错误的是( )A、黄铜和不锈钢都属于合金 B、羊毛和涤纶都属于合成纤维 C、太阳能和风能都属于清洁能源 D、石油和煤都属于不可再生能源9. 下列化肥属于复合肥的是( )A、KNO3 B、K2SO4 C、CO(NH2)2 D、Ca(H2PO4)210. 常用于改良酸性土壤的物质是( )
过滤
7. Cr2O3可以作为某些反应的催化剂,其中Cr元素的化合价是( )A、-3 B、+2 C、+3 D、+68. 下列说法中,错误的是( )A、黄铜和不锈钢都属于合金 B、羊毛和涤纶都属于合成纤维 C、太阳能和风能都属于清洁能源 D、石油和煤都属于不可再生能源9. 下列化肥属于复合肥的是( )A、KNO3 B、K2SO4 C、CO(NH2)2 D、Ca(H2PO4)210. 常用于改良酸性土壤的物质是( )
A、烧碱 B、小苏打 C、石灰石 D、熟石灰11. 下列微观粒子的结构示意图中,表示阳离子的是( )
A、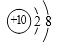 B、
B、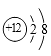 C、
C、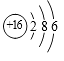 D、
D、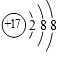 12. 下列关于氧气的说法正确的是( )A、空气中氧气含量最多 B、物质跟氧气反应都会发光发热 C、标准状况下氧气的密度比空气的密度小 D、鱼能在水中生存,说明水中溶解有氧气13. 下列关于化学方程式H2SO3+2H2=S↓+3H2O的理解,错误的是( )A、生成物有沉淀 B、反应物是H2SO3和H2 , 生成物是S和H2O C、该反应中,反应前后原子的种类和数目都不变 D、每1份质量的H2SO3和2份质量的H2完全反应,生成1份质量的S和3份质量的H2O14. 一种新型火箭推进剂在火箭发射过程中,发生反应的微观过程如下图所示。对于该反应中甲、乙、丙、丁物质类别的判断,错误的是( )
12. 下列关于氧气的说法正确的是( )A、空气中氧气含量最多 B、物质跟氧气反应都会发光发热 C、标准状况下氧气的密度比空气的密度小 D、鱼能在水中生存,说明水中溶解有氧气13. 下列关于化学方程式H2SO3+2H2=S↓+3H2O的理解,错误的是( )A、生成物有沉淀 B、反应物是H2SO3和H2 , 生成物是S和H2O C、该反应中,反应前后原子的种类和数目都不变 D、每1份质量的H2SO3和2份质量的H2完全反应,生成1份质量的S和3份质量的H2O14. 一种新型火箭推进剂在火箭发射过程中,发生反应的微观过程如下图所示。对于该反应中甲、乙、丙、丁物质类别的判断,错误的是( ) A、甲属于混合物 B、乙属于化合物 C、丙属于单质 D、丁属于氧化物15. 从分子的角度分析并解释下列事实,错误的是( )A、墙内开花墙外香-----分子在不断地运动 B、1滴水大约有1.67×1023个分子-----分子很小 C、将氮气制成液氮,体积变小------分子体积变小 D、醋酸是酸的,蔗糖是甜的-----不同种分子性质不同16. 只用水做试剂,不能将组内固体物质鉴别出来的一组是( )A、氯化钾、硫酸钾 B、硫酸铜、硫酸钠 C、碳酸钙、碳酸钠 D、硝酸铵、氢氧化钠17. 下列实验均来自初中课本,对其中实验现象的描述错误的是( )
A、甲属于混合物 B、乙属于化合物 C、丙属于单质 D、丁属于氧化物15. 从分子的角度分析并解释下列事实,错误的是( )A、墙内开花墙外香-----分子在不断地运动 B、1滴水大约有1.67×1023个分子-----分子很小 C、将氮气制成液氮,体积变小------分子体积变小 D、醋酸是酸的,蔗糖是甜的-----不同种分子性质不同16. 只用水做试剂,不能将组内固体物质鉴别出来的一组是( )A、氯化钾、硫酸钾 B、硫酸铜、硫酸钠 C、碳酸钙、碳酸钠 D、硝酸铵、氢氧化钠17. 下列实验均来自初中课本,对其中实验现象的描述错误的是( )
测定空气中氧气的含量
镁条在空气中燃烧
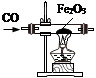
一氧化碳与氧化铁反应

用肥皂水区分硬水和软水
A.集气瓶内的水面上
升约至刻度“1”处
B.产生耀眼白光,
生成白色固体
C.玻璃管内红色粉
末变为黑色
D.软水中无泡沫,硬
水中有大量泡沫
A、A B、B C、C D、D18. 下列有关说法错误的是( )A、氯化钠、硫酸铵、氯酸钾都属于盐 B、过氧化氢和水的化学性质不同,是因为它们的分子构成不同 C、氢氧化钠和氢氧化钙的化学性质相似,是因为它们的水溶液中都含有氢氧根离子 D、某物质在空气中燃烧生成二氧化碳和水,说明该物质一定含有碳、氢、氧三种元素19. 关于下列实验方案中,实验设计能达到实验目的的是( )方案
实验目的
实验设计
A
探究稀盐酸与氢氧化钠溶液是否恰好完全反应
向反应后所得的溶液中滴加酚酞溶液
B
鉴别氯化钡、硫酸钾、碳酸钾、稀盐酸四种溶液
将组内物质相互混合,观察现象
C
除去氧化钙中少量的碳酸钙
加入足量的水,溶解,过滤
D
验证某可燃性混合气体中是否有一氧化碳
点燃气体,在火焰上方罩一个内壁涂有澄清石灰水的烧杯,观察石灰水是否变浑浊
A、A B、B C、C D、D20. 下列图像不能正确反映其对应关系的是( )
A、等质量的镁和氧气充分反应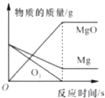 B、将氢氧化钠溶液滴入稀盐酸中
B、将氢氧化钠溶液滴入稀盐酸中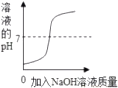 C、将质量分数为20%的稀硫酸分别滴入等质量的镁粉和铝粉中
C、将质量分数为20%的稀硫酸分别滴入等质量的镁粉和铝粉中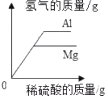 D、将一定质量分数的氢氧化钠溶液逐滴加入一定质量的氯化铁和盐酸的混合溶液中
D、将一定质量分数的氢氧化钠溶液逐滴加入一定质量的氯化铁和盐酸的混合溶液中 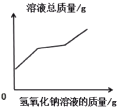
二、填空题
-
21. 用化学用语填空。
(1)、汞元素 ,(2)、2个氧分子 ,(3)、铁离子 ,(4)、3个铵根离子 ,(5)、氧化铝。22. 在丰富多彩的物质世界里,碳及其化合物占有重要的地位。(1)、金刚石和石墨均由碳元素组成,物理性质却相差很大,原因是它们的原子不同。(2)、活性炭具有很强的吸附能力,是因为它有的结构。(3)、我国在可燃冰开采技术的领域率先取得了重大突破,截至2017年5月18日,利用降压法连续产气12万立方米。可燃冰主要由甲烷分子和水分子组成,储量巨大,是未来的新能源。甲烷的化学式为 , 甲烷燃烧是将能转化成热能。科学家利用太阳能可将二氧化碳和水转化成合成气(CO和H2),再将CO和H2合成甲醇(CH3OH)。在合成甲醇的反应中,CO和H2的分子数之比是。
23. 水和溶液在生产、生活中有着重要的作用。(1)、生活中常用的方法降低水的硬度。(2)、下列物质在水中不能形成溶液的是 (填序号)。A、白糖 B、汽油 C、食盐 D、高锰酸钾(3)、甲、乙、丙三种固体物质在水中的溶解度曲线如下图所示。
①随温度升高,溶解度减小的物质是。
②t1℃时,分别向100g水中加入20g甲和20g乙,能形成
饱和溶液的是。
③下列有关叙述正确的是(填序号)。
A.t2℃时,甲的饱和溶液中溶质的质量分数为50%
B.分别将甲和乙的饱和溶液从t2℃降到t1℃时,析出固体的质量为甲>乙
C.从接近饱和的甲溶液中析出一定量的甲晶体后,剩余溶液的溶质质量分数变小
D.t2℃时,分别将50g甲、乙、丙固体溶于水,配成饱和溶液,需要水的质量为甲<乙<丙
24. C919是中国自主设计并且研制的第二种国产大型客机,最大航程5555公里,最大载客量为190座。 (1)、图中标示的材料中,属于有机合成材料的是。
(1)、图中标示的材料中,属于有机合成材料的是。
(2)、飞机机身大量使用铝合金。铝合金具有的优点有:密度小、抗腐蚀性、硬度比纯铝的。
(3)、钛(Ti)和钛合金被认为是21世纪重要的金属材料。以金红石(主要成分是TiO2)为原料生产钛的步骤有:
①在高温下,向金红石与焦炭的混合物中通入氯气(Cl2),得到TiCl4和一种可燃性气体。②在稀有气体环境和加热条件下,用Mg和TiCl4反应得到Ti和MgCl2。其中步骤①中的化学方程式为。
25. 填写实验报告。【实验目的】探究铜、铝、银的金属活动性顺序。
【实验过程】
实验内容
实验现象
解释或化学方程式
⑴将一根用砂纸打磨干净的铝线浸入硫酸铜溶液中。
铝线表面有色物质生成,溶液颜色变浅。
用砂纸打磨铝线的目的是。
⑵将一根用砂纸打磨干净的铜线浸入溶液中。
铜线表面有银白色物质生成,溶液由无色变成蓝色。
化学方程式:。
【实验结论】铜、铝、银的金属活动性顺序由强到弱为。
三、简答题
-
26. 广西北部湾拥有丰富的海洋资源。(1)、食用海鱼、海虾等海鲜可为人体提供的营养素主要是 (填序号)。A、糖类 B、蛋白质 C、维生素(2)、下图所示,是利用太阳能将海水淡化的过程,由海水变成淡水的过程属于(填“物理”或“化学”)变化。
 (3)、从海水中获取粗盐的方法是蒸发结晶,而不是降温结晶,理由是。(4)、海水提取粗盐后剩余的母液叫苦卤,利用苦卤制取金属镁的主要流程如下:
(3)、从海水中获取粗盐的方法是蒸发结晶,而不是降温结晶,理由是。(4)、海水提取粗盐后剩余的母液叫苦卤,利用苦卤制取金属镁的主要流程如下: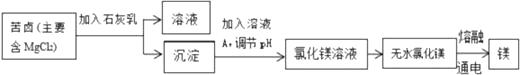
①流程中,溶液A为。
②测定氯化镁溶液的pH:用玻璃棒蘸取氯化镁溶液滴在上,然后在与对照,得出氯化镁溶液的pH。
27. A~G 是初中化学常见的7 种物质,分别由C、H、O、Cl、Ca中的一种或几种元素组成,已知A、B、C、D、E是不同类别的物质,G是可燃性气体,D的固体可用于人工降雨,这些物质之间相互关系如下图所示,图中“–”表示能相互反应,图中“→”表示转化关系,(部分反应物、生成物及反应条件已略去)。 (1)、写出D、F的化学式:D , F。(2)、写出 E 的一种用途:。(3)、B→G的基本反应类型是。(4)、写出一个由A转化为C的化学方程式:。
(1)、写出D、F的化学式:D , F。(2)、写出 E 的一种用途:。(3)、B→G的基本反应类型是。(4)、写出一个由A转化为C的化学方程式:。四、实验探究
-
28. 根据下列实验装置,回答问题。
A
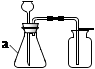 B
B 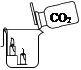 C
C 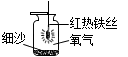 (1)、装置A中,仪器a的名称是。(2)、实验室常用 A 制取二氧化碳,反应的化学方程式为 , 证明二氧化碳已经集满的方法是。(3)、如图B所示,将二氧化碳慢慢倒入烧杯中,观察到蜡烛由低到高依次熄灭,说明二氧化碳具有的性质是、。(4)、实验室用装置A制取氧气,应选用的药品是 , 用装置C做铁丝在氧气中燃烧的实验时,集气瓶中细沙的作用是。29. 兴趣小组在做完盐的性质实验后,发现一瓶碳酸钠固体可能混入了氯化钠,硫酸钠中的一种或两种。为此,他们对这瓶固体的成分进行了探究。
(1)、装置A中,仪器a的名称是。(2)、实验室常用 A 制取二氧化碳,反应的化学方程式为 , 证明二氧化碳已经集满的方法是。(3)、如图B所示,将二氧化碳慢慢倒入烧杯中,观察到蜡烛由低到高依次熄灭,说明二氧化碳具有的性质是、。(4)、实验室用装置A制取氧气,应选用的药品是 , 用装置C做铁丝在氧气中燃烧的实验时,集气瓶中细沙的作用是。29. 兴趣小组在做完盐的性质实验后,发现一瓶碳酸钠固体可能混入了氯化钠,硫酸钠中的一种或两种。为此,他们对这瓶固体的成分进行了探究。
(1)、【实验验证】实验步骤
现象
结论、分析及化学方程式
①取少量该样品于烧杯中,加入
足量的水,溶解,得到溶液A。
②取少量溶液A于试管中,滴入
过量的稀硝酸。再滴入过量的硝
酸钡溶液,充分反应后,静置。
说明该固体中混有硫酸钠,写出证明有硫酸钠存在的化学方程式。
③取步骤②中的上层清液于
试管中,滴入几滴硝酸银溶液。
有白色沉淀生成。
说明该固体中。实验结束所得溶液中一定含有的阳离子是。
(2)、【实验反思】步骤②中滴入过量的稀硝酸的目的是。(3)、【实验拓展】兴趣小组还想测定该固体中碳酸钠的质量分数,利用如下图所示的实验装置(气体气密性良好)进行实验,每一步反应均完全进行。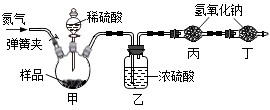
①为达实验目的,首先称取一定质量的该固体样品放入装置甲中,然后进行有关实验操作, 正确的顺序是(填序号,可重复)。
a.称量装置丙。 b.打开弹簧夹,通入足量的氮气,关闭弹簧夹。
c.打开分液漏斗的活塞,注入足量的稀硫酸,关闭活塞。
②装置乙的作用是。
五、计算题
-
30. 取碳酸钡和硫酸钡的混合物23.0g于烧杯中,将150.0g的稀盐酸平均分三次加入烧杯中,加入稀盐酸的质量与烧杯中固体的质量关系如下图所示,计算:
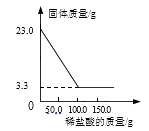 (1)、该混合物中硫酸钡的质量为g。(2)、恰好完全反应时所得溶液中溶质的质量分数(精确至0.1%)。
(1)、该混合物中硫酸钡的质量为g。(2)、恰好完全反应时所得溶液中溶质的质量分数(精确至0.1%)。