浙江省宁波市奉化二中2016-2017学年高二上学期化学期中考试试卷
试卷更新日期:2017-11-03 类型:期中考试
一、选择题
-
1. 下列各栏对应关系全部正确的是( )
选项
俗称
主要成分化学式
类别
A
纯碱
NaOH
碱
B
小苏打
NaHCO3
酸
C
磁铁矿
Fe2O3
金属氧化物
D
铝土矿
Al2O3
两性氧化物
A、A B、B C、C D、D2. “低碳经济,节能减排”是21世纪世界经济发展的新思路.”下列与之相悖的是( )A、开发水能、风能、太阳能、地热能、核能等新能源,减少使用煤、石油等化石燃料 B、大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 C、大力开采煤、石油和天然气,以满足经济发展的需要 D、大力发展新能源汽车,如混合动力汽车、电动汽车等,以减少碳、氮氧化物的排放3. 除去镁粉中的少量铝粉,可选用( )A、硫酸 B、氨水 C、盐酸 D、氢氧化钠溶液4. 下列烧杯中盛放的都是稀硫酸,在铜棒上不能产生气泡的是( )A、 B、
B、 C、
C、 D、
D、 5. 在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )A、v(A)=0.5 mol•L﹣1•s﹣1 B、v(B)=0.3 mol•L﹣1•s﹣1 C、v(C)=0.6 mol•L﹣1•s﹣1 D、v(D)=1.6 mol•L﹣1•s﹣16. 已知H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6kJ/mol,则反应HCl(g)═ H2(g)+ Cl2(g)的△H为( )A、+184.6kJ/mol B、﹣92.3kJ/mol C、﹣369.2kJ/mol D、+92.3kJ/mol7. 反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )A、
5. 在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )A、v(A)=0.5 mol•L﹣1•s﹣1 B、v(B)=0.3 mol•L﹣1•s﹣1 C、v(C)=0.6 mol•L﹣1•s﹣1 D、v(D)=1.6 mol•L﹣1•s﹣16. 已知H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6kJ/mol,则反应HCl(g)═ H2(g)+ Cl2(g)的△H为( )A、+184.6kJ/mol B、﹣92.3kJ/mol C、﹣369.2kJ/mol D、+92.3kJ/mol7. 反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )A、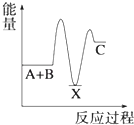 B、
B、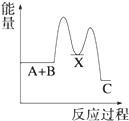 C、
C、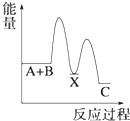 D、
D、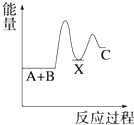 8. 下列变化过程中,需要吸收能量的是( )A、Cl2→Cl+Cl B、H+Cl→HCl C、C+O2→CO2 D、H++OH﹣→H2O9. 某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
8. 下列变化过程中,需要吸收能量的是( )A、Cl2→Cl+Cl B、H+Cl→HCl C、C+O2→CO2 D、H++OH﹣→H2O9. 某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( ) A、实验过程中没有热量损失 B、图中实验装置缺少环形玻璃搅拌棒 C、烧杯间填满碎纸条的作用是固定小烧杯 D、若改用60 mL 0.50 mol/L盐酸跟50 mL 0.5 mol/L的 NaOH溶液进行反应,从理论上说所求中和热不相等10. 2C(s)+O2(g)=2CO(g)△H=﹣221.0kJ•mol﹣1 , 这个热化学方程式表示( )A、2g碳燃烧生成一氧化碳时放出221.0kJ的热量 B、2mol碳燃烧生成一氧化碳时吸收221.0kJ的热量 C、2mol固体碳在氧气中燃烧生成2mol一氧化碳气体时放出221.0kJ的热量 D、12g碳和氧气反应生成一氧化碳时放出221.0kJ的热量11. 电化学装置工作时,下列电极上发生的反应一定是氧化反应的是( )A、阴极 B、负极 C、铜电极 D、石墨电极12. 下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )A、H+、NO3﹣、Fe2+、Na+ B、Ag+、NO3﹣、Cl﹣、K+ C、K+、Ba2+、OH﹣、SO42﹣ D、Cu2+、NH4+、Br﹣、OH﹣
A、实验过程中没有热量损失 B、图中实验装置缺少环形玻璃搅拌棒 C、烧杯间填满碎纸条的作用是固定小烧杯 D、若改用60 mL 0.50 mol/L盐酸跟50 mL 0.5 mol/L的 NaOH溶液进行反应,从理论上说所求中和热不相等10. 2C(s)+O2(g)=2CO(g)△H=﹣221.0kJ•mol﹣1 , 这个热化学方程式表示( )A、2g碳燃烧生成一氧化碳时放出221.0kJ的热量 B、2mol碳燃烧生成一氧化碳时吸收221.0kJ的热量 C、2mol固体碳在氧气中燃烧生成2mol一氧化碳气体时放出221.0kJ的热量 D、12g碳和氧气反应生成一氧化碳时放出221.0kJ的热量11. 电化学装置工作时,下列电极上发生的反应一定是氧化反应的是( )A、阴极 B、负极 C、铜电极 D、石墨电极12. 下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )A、H+、NO3﹣、Fe2+、Na+ B、Ag+、NO3﹣、Cl﹣、K+ C、K+、Ba2+、OH﹣、SO42﹣ D、Cu2+、NH4+、Br﹣、OH﹣二、选择题
-
13. 下列离子方程式的书写不正确的是( )A、氧化铝与盐酸反应:Al2O3+6H+═2Al3++3H2O B、氢氧化铝与NaOH溶液反应:Al(OH)3+OH﹣═AlO2﹣+2H2O C、向AlCl3溶液中滴加氨水:Al3++3OH﹣═Al(OH)3↓ D、向AlCl3溶液中加入过量NaOH溶液:Al3++4OH﹣═AlO2﹣+2H2O14. 根据能量变化示意图,下列热化学方程式正确的是( )
 A、N2(g)+3H2(g)=2NH3(g)△H=﹣(b﹣a)kJ•mol﹣1 B、N2(g)+3H2(g)=2NH3(g)△H=﹣(a﹣b)kJ•mol﹣1 C、2NH3(l)=N2(g)+3H2(g)△H=2(a+b﹣c)kJ•mol﹣1 D、2NH3(l)=N2(g)+3H2(g)△H=2(b+c﹣a)kJ•mol﹣115. 100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是( )A、加入适量的6mol/L的盐酸 B、加入数滴氯化铜溶液 C、加入适量蒸馏水 D、加入适量的氯化钠溶液16. 阻燃剂氢氧化铝受热分解时吸收热量,同时生成耐高温的氧化铝和水蒸气,起到防火作用.下列关于该阻燃剂防火原因的分析中错误的是( )
A、N2(g)+3H2(g)=2NH3(g)△H=﹣(b﹣a)kJ•mol﹣1 B、N2(g)+3H2(g)=2NH3(g)△H=﹣(a﹣b)kJ•mol﹣1 C、2NH3(l)=N2(g)+3H2(g)△H=2(a+b﹣c)kJ•mol﹣1 D、2NH3(l)=N2(g)+3H2(g)△H=2(b+c﹣a)kJ•mol﹣115. 100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是( )A、加入适量的6mol/L的盐酸 B、加入数滴氯化铜溶液 C、加入适量蒸馏水 D、加入适量的氯化钠溶液16. 阻燃剂氢氧化铝受热分解时吸收热量,同时生成耐高温的氧化铝和水蒸气,起到防火作用.下列关于该阻燃剂防火原因的分析中错误的是( )
A、氢氧化铝受热分解时吸收燃烧物表面的热量 B、氢氧化铝分解生成的水蒸气稀释燃烧物表面的氧气 C、氢氧化铝受热分解吸收热量使可燃物的着火点降低 D、氢氧化铝分解生成的氧化铝覆盖在燃烧物表面,使燃烧物与O2隔绝17. 最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
下列说法正确的是( )
A、CO和O生成CO2是吸热反应 B、在该过程中,CO断键形成C和O C、状态Ⅰ→状态Ⅲ表示CO和O反应生成CO2的过程 D、状态Ⅰ→状态Ⅲ表示CO与O2反应生成CO2的过程18. 在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量.下列表示氢氧化钠加入量(x)与溶液中沉淀的量(y)的关系示意图中正确的是( )A、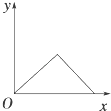 B、
B、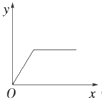 C、
C、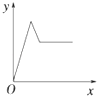 D、
D、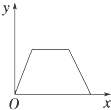 19. 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2﹣ . 下列叙述错误的是( )
19. 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2﹣ . 下列叙述错误的是( ) A、c电极是正极,发生还原反应 B、B口通入的是甲烷,发生氧化反应 C、放电时O2﹣离子向d极移动 D、d极上的电极反应式为:CH4+4O2﹣+8e﹣=CO2↑+2H2O20. 已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ•mol﹣1
A、c电极是正极,发生还原反应 B、B口通入的是甲烷,发生氧化反应 C、放电时O2﹣离子向d极移动 D、d极上的电极反应式为:CH4+4O2﹣+8e﹣=CO2↑+2H2O20. 已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ•mol﹣1N2(g)+O2(g)═2NO(g)△H=+180kJ•mol﹣1
则2CO(g)+2NO(g)═N2(g)+2CO2(g)的△H是( )
A、﹣386 kJ•mol﹣1 B、+386 kJ•mol﹣1 C、﹣746 kJ•mol﹣1 D、+746 kJ•mol﹣121. 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( ) A、氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 B、铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 C、电镀工业中,X是待镀金属,Y是镀层金属 D、外加电流的阴极保护法中,Y是待保护金属22. 某研究小组为探究铁发生电化学腐蚀的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化(结果如图2).下列叙述错误的是( )
A、氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 B、铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 C、电镀工业中,X是待镀金属,Y是镀层金属 D、外加电流的阴极保护法中,Y是待保护金属22. 某研究小组为探究铁发生电化学腐蚀的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化(结果如图2).下列叙述错误的是( ) A、图2中,t2时容器中压强明显小于起始压强是因为铁粉发生了吸氧腐蚀 B、碳粉表面的电极反应式只有:2H2O+O2+4e﹣═4OH﹣ C、碳粉表面一定发生了还原反应 D、图3中,发生腐蚀时电子转移方向如箭头所示
A、图2中,t2时容器中压强明显小于起始压强是因为铁粉发生了吸氧腐蚀 B、碳粉表面的电极反应式只有:2H2O+O2+4e﹣═4OH﹣ C、碳粉表面一定发生了还原反应 D、图3中,发生腐蚀时电子转移方向如箭头所示三、填空题
-
23. 在体积为2L的密闭容器中发生2SO2+O2⇌2SO3反应,现控制下列三种不同的条件:①在400℃时,10molSO2与5molO2反应;
②在400℃时,20molSO2与5molO2反应;
③在300℃时,10molSO2与5molO2反应;
(1)、开始时,化学反应速率快慢顺序是;(2)、若10min内测得第①组的平均反应速率为:V(SO2)=0.4mol/(L•min),则V(O2)= , 10min时,SO3浓度为 .24. 2SO2(g)+O2(g)⇌2SO3(g)△H=a kJ•mol﹣1 , 反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答: (1)、图中A点表示 , a= .(2)、Ea的大小对该反应的△H(填“有”或“无”)影响.(3)、已知常温常压下单质硫的燃烧热为296kJ•mol﹣1 , 由单质硫和氧气经两步反应,生成3mol SO3(g),放出的总热量为 .25. 请完成下列问题(1)、已知红磷比白磷稳定,则反应
(1)、图中A点表示 , a= .(2)、Ea的大小对该反应的△H(填“有”或“无”)影响.(3)、已知常温常压下单质硫的燃烧热为296kJ•mol﹣1 , 由单质硫和氧气经两步反应,生成3mol SO3(g),放出的总热量为 .25. 请完成下列问题(1)、已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)═2P2O5(s)△H1;
4P(红磷,s)+5O2(g)═2P2O5(s)△H2;
△H1和△H2的关系是△H1△H2(填“>”、“<”)
(2)、由N2O和NO反应生成1mol N2和NO2的能量变化如图所示,请写出该反应的热化学方程式 (3)、在298K、101kPa时,已知:
(3)、在298K、101kPa时,已知:①2H2O(g)═O2(g)+2H2(g)△H1;
②Cl2(g)+H2(g)═2HCl(g)△H2;
③2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3 ,
则△H3与△H1和△H2之间的关系正确的是 .
A、△H3=△H1+2△H2 B、△H3=△H1+△H2 C、△H3=△H1﹣2△H2 D、△H3=△H1﹣△H2(4)、已知H2(g)+Br2(g)═2HBr(g)△H=﹣72kJ・mol﹣1 , 相关键能数据如表:物质
H2(g)
Br2(g)
HBr(g)
1mol分子中的化学键断裂时需要吸收的能量(kJ)
436
200
a
则表中a= .
26. 根据问题进行作答:
(1)、事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ( )
A、C(s)+H2O(g)=CO(g)+H2(g)△H>0 B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0 C、2CO(g)+O2(g)=2CO2(l)△H<0 D、2H2(g)+O2(g)═2H2O(l)△H<0(2)、以KOH溶液为电解质溶液,依据(1)中所选反应设计一个原电池,其正极的电极反应式为:
(3)、镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是:
(4)、利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于 (填M或者N)处,此时溶液中的阴离子向 极(填X或铁)移动.
四、实验题
-
27. 某化学课外兴趣小组为探究NO气体易被空气氧化,并观察NO气体的实际颜色,同时为了防止气体扩散污染空气,对实验室制取NO气体的装置改装如下:

打开止水夹Ⅰ,Ⅱ,从漏斗处加入稀硝酸,直至液面浸没铜丝并与试管A胶塞处相平齐时,关闭止水夹Ⅰ,Ⅱ,用酒精灯微热试管A.
(1)、加入稀硝酸与试管A胶塞处相平齐的目的是 .(2)、当用酒精灯微热试管A时,A中反应加快,请写出反应方程式 .(3)、当进入B试管的液体没及铜丝后,再微热B试管,此时B试管中能观察到的现象是 .(4)、为了防止气体污染空气,C烧杯中应装入 溶液.A、NaOH 溶液 B、CuSO4溶液 C、NaCl溶液 D、AgNO3溶液、