湖北省重点高中联考2016-2017学年高二上学期化学期中考试试卷
试卷更新日期:2017-11-03 类型:期中考试
一、选择题
-
1. “生物质能”主要是指树木、庄稼、草类等植物直接或间接提供的能量;古老的柴火做饭、烧炭取暖等粗放用能方式正被现代科学技术所改变,下面说法错误的是( )A、生物质能的缺点是严重污染环境 B、生物质能源是可再生的能源 C、利用生物质能就是间接利用太阳能 D、使用沼气这种生物质能是对化学能的充分利用2. 下列反应属于吸热反应的是( )
①锌粒与稀H2SO4反应制取H2
②氢气在氧气中燃烧
③碳酸钙高温分解成氧化钙和二氧化碳
④氢氧化钾和硫酸中和
⑤Ba(OH)2•8H2O与NH4Cl反应
⑥氢气还原氧化铜
⑦葡萄糖在人体内氧化分解
⑧钢铁制品生锈的反应.
A、③⑤⑥⑦⑧ B、③⑤⑥ C、①③④⑤⑥⑧ D、①②③④⑤⑥3. 已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=﹣Q1 kJ•mol﹣12H2(g)+O2(g)═2H2O(g);△=﹣Q2 kJ•mol﹣1 ,
2H2(g)+O2(g)═2H2O(l);△H2=﹣Q3 kJ•mol﹣1
常温下,取体积比2:3的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A、0.4Q1+0.15Q2 B、0.2Q1+0.05Q2 C、0.2Q1+0.15Q3 D、0.2Q1+0.3Q24. 下列说法正确的是( )A、升高体系的温度或增加某一组分的浓度均能增加反应体系中活化分子所占百分数 B、H2+Cl2 2HCl反应中化学能只转变为热能 C、面粉生产工厂要求严禁烟火是因为面粉有机物颗粒极大,总表面积巨大容易被引燃爆炸 D、高锰酸钾受热分解是一个熵减小的过程5. 下面关于化学反应的限度的叙述中,正确的是( )A、化学反应的限度都相同 B、可以通过改变温度控制化学反应的限度 C、可以通过延长化学反应的时间改变化学反应的限度 D、当一个化学反应在一定条件下达到限度时,反应即停止6. 已知相同条件下,下列反应的焓变和平衡常数分别表示为:①2H2O(g)=O2(g)+2H2(g)△H1 K1=x
②Cl2(g)+H2(g)=2HCl(g)△H2 K2=y
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3 K3=x
则下列关系正确的是( )
A、△H3=△H1+2△H2 x=xy2 B、H3=△H1+△H2 z=x+y C、H3=△H1+2△H2 x=x﹣y2 D、H3=△H1+△H2 z=7. 下列说法错误的是( )A、S(g)+O2(g)=SO2(g)△H3S(s)+O2(g)=SO2(g)△H2 , 则△H1<△H2 B、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=﹣216kJ•mol﹣1 , 则反应总能量>生成物总能量 C、已知C(石墨•s)=C(金刚石•s)△H>0,则石墨比金刚石稳定 D、相同条件下,如果1mol氢原子所具有的能量为E1•1mol氢分子所具有的能量为E2 , 则2E1=E28. 下列事实不能用勒夏特列原理解释的是( )A、工业合成氨中,将氨气液化分离以提高氨气产率 B、开启啤酒瓶后,瓶中马上泛起大量泡沫 C、实验室中常用排饱和食盐水的方法收集氯气 D、两支试管中分别加入等体积5%的H3O2溶液,在其中一支试管中加入2~3滴FeCl3溶液,该试管中产生气泡快9. 一定条件下,将SO2与O2以休枳比2:1置于一体积不变的密闭容器中发生反应2SO2(g)+O2(g)⇌2SO2(g),能说明该反应已达到平衡的是)( )①容器内的气体分子总数不再变化
②体系的密度不发生变化
③体系中硫元素的质量百分含量不再变化
④单位时间内转移4mol电子,同时消耗2molSO3
⑤SO2与SO3的体枳比保持不变
⑥v正(SO3)=2V正(O2)
A、①⑤⑥ B、①③⑤⑥ C、①③④⑤ D、①②③④10. 对于可逆反应:2A(g)+B(g)⇌2C(g)△H<0,下列各图中正确的是( )A、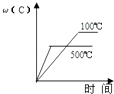 B、
B、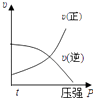 C、
C、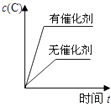 D、
D、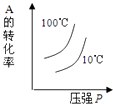 11. 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A,B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )A、均减半 B、均加倍 C、均增加1mol D、均减少1mol12. 有关下列图象说法错误的是( )A、
11. 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A,B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )A、均减半 B、均加倍 C、均增加1mol D、均减少1mol12. 有关下列图象说法错误的是( )A、 图阴影部分面积表示反应物浓度的净减少量M
B、
图阴影部分面积表示反应物浓度的净减少量M
B、 图虚线b表示反应加入催化剂后能量变化曲线
C、
图虚线b表示反应加入催化剂后能量变化曲线
C、 图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)⇌2Z(g)
D、
图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)⇌2Z(g)
D、 图对应于反应H2(g)+CO2(g)⇌H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的
13. 在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)⇌M2R4(g),加入1mol M2和2molR2 , 反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( )
图对应于反应H2(g)+CO2(g)⇌H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的
13. 在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)⇌M2R4(g),加入1mol M2和2molR2 , 反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( ) A、M2既可能为固体,也可能为气体 B、达到平衡后,保持容器容枳和温度不变,再加入1molM2和2molR2 , 则R2转化率不变 C、达到平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,R2的浓度可能是原平衡时的1.8倍 D、若M2为气体,达到平衡后,保持容器容积和温度不变,再加入1molM2R4 , 则新的平衡时气体的平均相对分子质量增大14. 能用焓判据判断下列过程方向的是( )A、湿的衣服经过晾晒变干 B、硝酸铵溶于水 C、100℃时的水蒸气凝结成水 D、25℃、101kPa时2N2O5(g)=4NO2(g)+O2(g)△H=+56.7kJ/mol能自发进行15. 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)⇌CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
A、M2既可能为固体,也可能为气体 B、达到平衡后,保持容器容枳和温度不变,再加入1molM2和2molR2 , 则R2转化率不变 C、达到平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,R2的浓度可能是原平衡时的1.8倍 D、若M2为气体,达到平衡后,保持容器容积和温度不变,再加入1molM2R4 , 则新的平衡时气体的平均相对分子质量增大14. 能用焓判据判断下列过程方向的是( )A、湿的衣服经过晾晒变干 B、硝酸铵溶于水 C、100℃时的水蒸气凝结成水 D、25℃、101kPa时2N2O5(g)=4NO2(g)+O2(g)△H=+56.7kJ/mol能自发进行15. 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)⇌CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( ) A、反应物的总能量低于生成物的总能量 B、△t1=△t2时,CO的转化率:a~b段小于b〜c段 C、反应在c点达到平衡状态 D、反应物浓度:a点小于b点16. 已知NO2和N2O4可以相互转化:2NO2(g)⇌N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( )
A、反应物的总能量低于生成物的总能量 B、△t1=△t2时,CO的转化率:a~b段小于b〜c段 C、反应在c点达到平衡状态 D、反应物浓度:a点小于b点16. 已知NO2和N2O4可以相互转化:2NO2(g)⇌N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( ) A、前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(L•min) B、反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g) C、若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g) D、a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d
A、前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(L•min) B、反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g) C、若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g) D、a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d二、非选择题
-
17. 化学反应速率是化学反应原理的重要组成部分.请回答下列问题:(1)、已知一定条件下发生反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件).
 (2)、探究反应条件对0.10mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:
(2)、探究反应条件对0.10mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:编号
反应温度/℃
Na2S2O3浓液/mL
甲
0.1mol/LH2SO4溶液/mL
乙
①
25℃
10.0
0
10.0
②
25℃
5.0
a
10.0
③
45℃
10.0
0
10.0
上述实验①③是探究对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为 , a为;乙是实验需要测量的物理量,则表格中“乙”为 .
(3)、已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入(填字母序号).
A.硫酸钾B.氯化锰c.硫酸锰D.水.
18. 化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示: (1)、该图中有两处仪器未画出,它们是、 .(2)、写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为(中和热数值为57.3kJ/mol) .(3)、取55mLNaOH溶液和25mL硫酸溶液进行实验,实验数据如表.
(1)、该图中有两处仪器未画出,它们是、 .(2)、写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为(中和热数值为57.3kJ/mol) .(3)、取55mLNaOH溶液和25mL硫酸溶液进行实验,实验数据如表.实验次数
起始温度t1/℃
终止温度t2/℃
H2SO4
NaOH
平均值
①
26.2
26.0
26.1
30.1
②
27.0
27.4
27.2
33.3
③
25.9
25.9
25.9
29.8
④
26.4
26.2
26.3
30.4
近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm2 , 中和后生成溶液的比热容c=4.08J/(g•℃).则中和热△H=(取小数点后一位).
(4)、有关中和热测定实验,下列说法错误的是a.用温度计测定NaOH溶液起始温度后马上直接测定H2SO4溶液的温度会导致中和热数值比57.3低
b.温度计的冲洗液应倒入小烧杯参与反应
c.混合硫酸和氢氧化钠溶液时应分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.若装置完全相同,操作均没失误,取110mLNaOH溶液和50mL硫酸溶液进行实验,误差比55mLNaOH溶液和25mL硫酸溶液进行实验误差小.
19. 工业上通常采用N2(g)和H2(g)崔华成NH3(g):N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1(1)、在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3 , 判断平衡移动的方向是(填“正向移动”“逆向移动”或“不移动”).(2)、若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为 .(3)、一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:容器
甲
乙
丙
反应物投入量
1molN2、3molH2
2molNH3
4molNH3
平衡时数据
反应能量变化的绝对值(kJ)
Q1
Q2
Q3
反应物转化率
a1
a2
a3
体系压强(Pa)
p1
P2
P3
则Q1+Q2=kJ;a1+a2l(填“<”“>”或“=”•下同):2p2p3
(4)、如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2 , 将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2 , 一段时间又达到平衡时,B的体积为L(连通管中气体体积不计). 20. 甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)⇌CH3OH(g).已知常温常压下反应的能量变化如图1所示:
20. 甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)⇌CH3OH(g).已知常温常压下反应的能量变化如图1所示:
②
化学键
H﹣H
H﹣O
O=O
键能kj/mol
436
x
496
③CO(g)+ O2(g)=CO2(g)△H=﹣280kJ/mol
H2(g)+ O2(g)=H2O(I)△H=﹣284kJ/mol
H2O(I)=H2O(g)△H=+44kJ/mol
请回答下列问题:
(1)、甲醇气体分解为CO和H2两种气体这一反应的活化能为kj/mol;(2)、请写出表示气态甲醇燃烧热的热化学方程式;(3)、H﹣O的键能x值为;(4)、如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L.如反应开始时仍充入10molCO和30molH2 , 则在平衡状态B时容器的体积V(B)=L;(5)、在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:容器
甲
乙
丙
相关条件
恒温恒容
绝热恒容
恒温恒压
反应物投料
1molCO、2molH2
1molCH3OH
1molCH3OH
平衡时容器体积
V(甲)
V(乙)
V(丙)
反应的平衡常数K
K(甲)
K(乙)
K(丙)
平衡时CH3OH的浓度/mol•L﹣1
C(甲)
C(乙)
C(丙)
平衡时CH3OH的反应速率/mol•L﹣1•min﹣1
v(甲)
v(乙)
v(丙)
则下列说法正确的是 .
A、V(甲)>V(丙) B、K(乙)>K(丙) C、c(乙)>c(甲) D、v(甲)=v(丙)21. 研究表明,CO2和H2在相同条件下能同时发生两个平行反应,化学方程式如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H3<0Ⅰ
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2>0Ⅱ
催化剂A和催化剂B对这两个反应均具有催化能力.某实验室控制CO2和H2初始投料比为1:2.2.在相同压强下,经过相同反应时间测得如表实验数据:
实验编号
T(K)
催化剂
CO2转化率(%)
甲醇选择性(%)
①
543
催化剂 A
12.3
42.3
②
543
催化剂B
10.9
72.7
③
553
催化剂 A
15.3
39.1
④
553
催化剂B
12.0
71.6
【备注】甲醇选择性:转化的CO2中生成甲醇的百分比.
(1)、测得实验数据时,反应(填“是”或“不是”)处于平衡态.(2)、有利于提高CO2转化为CH3OH平衡转化率的措施有 .A、使用催化剂A B、使用催化剂B C、降低反应温度 D、投料比不变,增加反应物的浓度 E、增大CO2和H2的初始投料比(3)、表中实验数据表明:在相同温度下,因为 , 所以在该时刻不同的催化剂对CO2转化成CH3OH的选择性有显著的影响.