广东省茂名市高州中学2016-2017学年高二上学期化学期中考试试卷(理科)
试卷更新日期:2017-11-03 类型:期中考试
一、选择题
-
1. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、1L0.1 mol•L﹣1的氨水中含有0.1NA个OH﹣ B、78gNa2O2固体中含有的阴离子数目为2NA C、常温下,23gNO2和N2O4的混合气体含有NA个氧原子 D、常温下,4gCH4中含有4NA个C﹣H共价键2. 如表所示的五种元素中,W,X,Y,Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法不正确的是( )
X
Y
W
Z
T
A、X,Y,Z三种元素最低价氢化物的沸点依次升高 B、由X,Y和氢三种元素形成的化合物中有共价键 C、物质WY2、W3X4均有熔点高、硬度大的特性 D、T元素肯定是金属元素3. 下列说法正确的是( )A、化学反应中的能量变化都表现为热量的变化 B、需要加热才能发生的反应一定是吸热反应 C、放热反应在常温下一定很容易发生 D、反应是吸热还是放热必须看反应物和生成物的总能量的大小4. 有一化学平衡:mA(g)+nB(g)⇌pC(g)+qD(g).如图表示的是A的转化率与压强、温度T的关系.分析图中曲线可以得出的结论是( )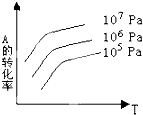 A、正反应吸热,m+n>p+q B、正反应吸热,m+n<p+q C、正反应放热,m+n>p+q D、正反应放热,m+n<p+q5. 在相同温度下,0.01mol•L﹣1 NaOH溶液和0.01mol•L﹣1的盐酸相比,下列说法正确的是( )A、由水电离出的[H+]相等 B、由水电离出的[H+]都是1.0×10﹣12 mol•L﹣1 C、由水电离出的[OH﹣]都是0.01 mol•L﹣1 D、两者都促进了水的电离6. 下列说法或表示方法正确的是( )A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 B、在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ C、由C(s,石墨)=C(s,金刚石)△H=+1.90kJ/mol可知,石墨没有金刚石稳定 D、在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=﹣285.8kJ/mol7. 下列叙述正确的是( )A、某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b B、常温下,某溶液中由水电离的c(OH﹣)=1.0×10﹣13 , 则此溶液一定呈酸性 C、25℃时,将pH=4的盐酸稀释1000倍后,溶液的pH=7 D、25℃时,pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强碱与强酸的体积比是1:108. 如图所示,是在其它条件一定时,反应2A+B⇌2C△H<0,A的最大转化率与温度关系曲线,下列叙述正确的是( )
A、正反应吸热,m+n>p+q B、正反应吸热,m+n<p+q C、正反应放热,m+n>p+q D、正反应放热,m+n<p+q5. 在相同温度下,0.01mol•L﹣1 NaOH溶液和0.01mol•L﹣1的盐酸相比,下列说法正确的是( )A、由水电离出的[H+]相等 B、由水电离出的[H+]都是1.0×10﹣12 mol•L﹣1 C、由水电离出的[OH﹣]都是0.01 mol•L﹣1 D、两者都促进了水的电离6. 下列说法或表示方法正确的是( )A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 B、在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ C、由C(s,石墨)=C(s,金刚石)△H=+1.90kJ/mol可知,石墨没有金刚石稳定 D、在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=﹣285.8kJ/mol7. 下列叙述正确的是( )A、某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b B、常温下,某溶液中由水电离的c(OH﹣)=1.0×10﹣13 , 则此溶液一定呈酸性 C、25℃时,将pH=4的盐酸稀释1000倍后,溶液的pH=7 D、25℃时,pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强碱与强酸的体积比是1:108. 如图所示,是在其它条件一定时,反应2A+B⇌2C△H<0,A的最大转化率与温度关系曲线,下列叙述正确的是( )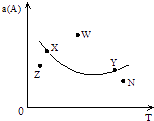 A、X或Y两点相应,V(正)>V(逆) B、Z、N两点表示未达平衡状态,且都是V(正)>V(逆) C、W点表示非平衡状态,V(正)>V(逆) D、相应反应速率大小的点:W>Y>N9. 一定温度下,将4molPCl3和2molCl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2⇌PCl5 , 各物质均为气态.达平衡后,PCl5为0.8mol.若此时再移走2molPCl3和1molCl2 , 相同温度下达到平衡,PCl5的物质的量为( )A、0.8mol B、0.4mol C、0.4mol<x<0.8mol D、<0.4mol10. 已知在298K时下述反应的有关数据:
A、X或Y两点相应,V(正)>V(逆) B、Z、N两点表示未达平衡状态,且都是V(正)>V(逆) C、W点表示非平衡状态,V(正)>V(逆) D、相应反应速率大小的点:W>Y>N9. 一定温度下,将4molPCl3和2molCl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2⇌PCl5 , 各物质均为气态.达平衡后,PCl5为0.8mol.若此时再移走2molPCl3和1molCl2 , 相同温度下达到平衡,PCl5的物质的量为( )A、0.8mol B、0.4mol C、0.4mol<x<0.8mol D、<0.4mol10. 已知在298K时下述反应的有关数据:C(s)+ O2(g)=CO(g)△H1=﹣110.5kJ/mol
C(s)+O2(g)=CO2(g),△H2=﹣393.5kJ/mol
则C(s)+CO2(g)=2CO(g)的△H 为( )
A、283.5kJ/mol B、172.5kJ/mol C、﹣172.5kJ/mol D、﹣504 kJ/mol11. 已知H﹣H键的键能为436kJ/mol,O═O键的键能为498kJ/mol,根据热化学方程式H2(g)+ O2(g)═H2O(l)△H=﹣286kJ/mol,判断H2O分子中O﹣H键的键能为( )A、485.5 kJ/mol B、610 kJ/mol C、917 kJ/mol D、1 220 kJ/mol12. 在一密闭容器中,反应aA(g)⇌bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是( )A、平衡向正反应方向移动了 B、物质A的转化率增大了 C、物质B的质量分数增加了 D、a>b13. 已知:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1;
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1 .
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
A、1:1 B、1:3 C、1:4 D、2:314. 25℃时,水的电离达到平衡:H2O⇌H++OH﹣△H>0,下列叙述正确的是( )A、向水中加入氨水,平衡逆向移动,c(OH﹣)降低 B、向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 C、向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 D、将水加热,KW增大,pH不变15. 向三份1mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO﹣浓度的变化依次为( )A、减小、增大、减小 B、增大、减小、减小 C、减小、增大、增大 D、增大、减小、增大16. 下列反应能用勒夏特列原理解释的是( )A、由SO2和O2反应制SO3需使用催化剂 B、燃烧粉碎的黄铁矿矿石有利于三氧化硫的生成 C、硫酸生产中用98.3%的硫酸吸收SO3 , 而不用水或稀硫酸吸收SO3 D、用氮气和氢气合成氨需采用高压17. 在一密闭容器中进行以下可逆反应:M(g)+N(g)⇌P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( )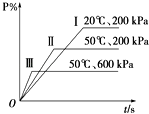 A、正反应放热,L是固体 B、正反应放热,L是气体 C、正反应吸热,L是气体 D、正反应放热,L是固体或气体18. 在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )A、v(A)=0.5 mol•L﹣1•s﹣1 B、v(B)=0.3 mol•L﹣1•s﹣1 C、v(C)=0.8 mol•L﹣1•s﹣1 D、v(D)=1 mol•L﹣1•s﹣119. 室温时,下列溶液等体积混合后pH一定小于7的是( )A、pH=3的盐酸和pH=11的氨水 B、pH=3的盐酸和pH=11的氢氧化钡溶液 C、pH=3的硫酸和pH=11的氨水 D、pH=3的醋酸和pH=11的氢氧化钡溶液20. 对于密闭容器中进行的反应N2(g)+O2(g)⇌2NO(g),下列条件能加快其反应速率的是( )A、增大体积使压强减小 B、体积不变,充入N2使压强增大 C、体积不变,充入He使压强增大 D、压强不变,充入气体Ne
A、正反应放热,L是固体 B、正反应放热,L是气体 C、正反应吸热,L是气体 D、正反应放热,L是固体或气体18. 在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )A、v(A)=0.5 mol•L﹣1•s﹣1 B、v(B)=0.3 mol•L﹣1•s﹣1 C、v(C)=0.8 mol•L﹣1•s﹣1 D、v(D)=1 mol•L﹣1•s﹣119. 室温时,下列溶液等体积混合后pH一定小于7的是( )A、pH=3的盐酸和pH=11的氨水 B、pH=3的盐酸和pH=11的氢氧化钡溶液 C、pH=3的硫酸和pH=11的氨水 D、pH=3的醋酸和pH=11的氢氧化钡溶液20. 对于密闭容器中进行的反应N2(g)+O2(g)⇌2NO(g),下列条件能加快其反应速率的是( )A、增大体积使压强减小 B、体积不变,充入N2使压强增大 C、体积不变,充入He使压强增大 D、压强不变,充入气体Ne二、解答题
-
21. 利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁.其工艺流程如图:
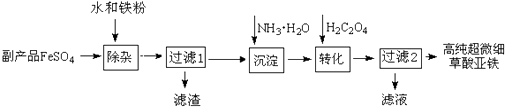 (1)、已知过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3 , 请写出TiOSO4水解成 H2TiO3沉淀的化学方程式:;铁粉的作用有:①除去溶液中的Fe3+ , ② .(2)、沉淀反应的离子方程式是 .(3)、沉淀过程的反应温度为40℃,温度不宜过高的原因除控制沉淀的粒径之外,还有 .(4)、FeC2O4生成时,要在真空环境下进行,原因是 .(5)、过滤2得到的滤液经蒸发浓缩、 , 可得到副产品.22. 将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应:3A+B⇌2C,在反应过程中C的物质的量分数随温度变化如图所示:
(1)、已知过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3 , 请写出TiOSO4水解成 H2TiO3沉淀的化学方程式:;铁粉的作用有:①除去溶液中的Fe3+ , ② .(2)、沉淀反应的离子方程式是 .(3)、沉淀过程的反应温度为40℃,温度不宜过高的原因除控制沉淀的粒径之外,还有 .(4)、FeC2O4生成时,要在真空环境下进行,原因是 .(5)、过滤2得到的滤液经蒸发浓缩、 , 可得到副产品.22. 将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应:3A+B⇌2C,在反应过程中C的物质的量分数随温度变化如图所示: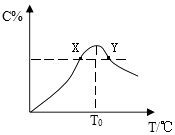 (1)、T0对应的反应速率v(正)v(逆)(用“=”、“>”或“<”表示,下同);(2)、此反应的正反应为热;(填“放”或“吸”)(3)、X、Y两点A物质正反应速率的大小关系是YX;(4)、温度T<T0时,C%逐渐增大的原因是:;(5)、若Y点的C的物质的量分数为25%,则参加反应的A物质的量为mol.23. 对可逆反应aA(g)+bB(g)⇌cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系: =K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,在850℃时,K=1.(1)、若升高温度到950℃,达到平衡时K1(填“大于”、“小于”或“等于”)(2)、850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和5.0mol H2时,上述平衡向(填“正反应”或“逆反应”)方向移动.24. CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
(1)、T0对应的反应速率v(正)v(逆)(用“=”、“>”或“<”表示,下同);(2)、此反应的正反应为热;(填“放”或“吸”)(3)、X、Y两点A物质正反应速率的大小关系是YX;(4)、温度T<T0时,C%逐渐增大的原因是:;(5)、若Y点的C的物质的量分数为25%,则参加反应的A物质的量为mol.23. 对可逆反应aA(g)+bB(g)⇌cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系: =K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,在850℃时,K=1.(1)、若升高温度到950℃,达到平衡时K1(填“大于”、“小于”或“等于”)(2)、850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和5.0mol H2时,上述平衡向(填“正反应”或“逆反应”)方向移动.24. CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:①2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=﹣890.3kJ•mol﹣1
②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1
③C(s)+O2(g)═CO2(g)△H=﹣393.5Kj•mol﹣1
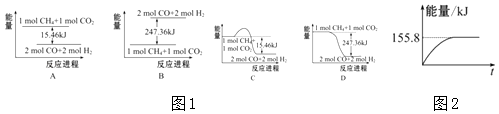 (1)、在深海中存在一种甲烷细菌,它们依靠酶使甲烷气体与O2作用而产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量(填“>”、“<”或“=”)890.3kJ.(2)、甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2 , 1g CH4完全反应可释放15.46kJ的热量,则:
(1)、在深海中存在一种甲烷细菌,它们依靠酶使甲烷气体与O2作用而产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量(填“>”、“<”或“=”)890.3kJ.(2)、甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2 , 1g CH4完全反应可释放15.46kJ的热量,则:①图1(所有物质均为气态)能表示该反应过程中能量变化的是(填字母).
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图2所示,则CH4的转化率为 .
(3)、C(s)与H2(g)不反应,所以C(s)+2H2(g)═CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)═CH4(g)的反应热△H= .(4)、目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是 (填字母).A、寻找优质催化剂,使CO2与H2O反应生成CH4与O2 , 并放出热量 B、将固态碳合成为C60 , 以C60作为燃料 C、寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)25. 某种食用精制盐包装袋上有如表说明:产品标准
GB5461
产品等级
一级
配 料
食盐、碘酸钾、抗结剂
碘含量(以I计)
20~50mg/kg
分装时期
分装企业
(1)、碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)KIO3+KI+H2SO4═K2SO4+I2+H2O(2)、上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.①Na2SO3稀溶液与I2反应的离子方程式是 .
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是 , 上述操作正确的顺序是:(填序号)
(3)、已知:I2+2S2O32﹣═2I﹣+S4O62﹣ . 某学生测定食用精制盐的碘含量,其步骤为:a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10﹣3mol•L﹣1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是 .
②b中反应所产生的I2的物质的量是mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)mg/kg.