浙江省宁波鄞州区九校2017-2018学年九年级上学期科学月考试卷
试卷更新日期:2017-10-31 类型:月考试卷
一、单选题
-
1. 下列说法错误的是( )A、水银不是银 B、盐酸不是酸 C、干冰不是冰 D、纯碱不是碱2. 某有机物M在足量氧气中充分燃烧的化学方程式如下:2M + 13O2 → 8CO2 +10H2O。则M的化学式为( )A、C4H10 B、CH4 C、CH4O D、C2H4O23. 下列对甲、乙、丙、丁四个实验的相关说法中,正确的是( )
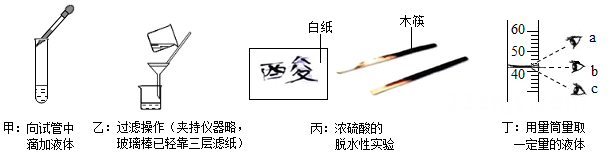 A、向试管中滴加液体,如图甲所示,这样可保证将液体滴入试管 B、按图乙所示进行过滤操作,玻璃棒的倾斜角度不合适,这样很可能使液体外漏 C、如图丙所示,浓硫酸使白纸、木筷变黑,是因为浓硫酸吸收了纸和木筷中的水 D、图丁所示的三次读数, b读数方法正确,c的读数比实际液体体积大4. 金属钯(Pd)是种用于制首饰的银白色贵金属,现进行如下三个实验:
A、向试管中滴加液体,如图甲所示,这样可保证将液体滴入试管 B、按图乙所示进行过滤操作,玻璃棒的倾斜角度不合适,这样很可能使液体外漏 C、如图丙所示,浓硫酸使白纸、木筷变黑,是因为浓硫酸吸收了纸和木筷中的水 D、图丁所示的三次读数, b读数方法正确,c的读数比实际液体体积大4. 金属钯(Pd)是种用于制首饰的银白色贵金属,现进行如下三个实验:实验一
实验二
实验三
实验操作
将钯丝伸入稀盐酸
将银丝伸入PdCl2溶液
将铂丝伸入PdCl2溶液
实验现象
无明显现象
银丝表面析出固体 溶液中出现白色沉淀
无明显现象
由上述现象可知,钯在金属活动性顺序中位于( )
A、 氢之前 B、银和铂之间 C、氢和银之间 D、铂之后5. 不能达到实验目的的方案是( )A、用稀硫酸鉴别炭粉和氧化铜 B、用锌粒鉴别食盐水和稀盐酸 C、用硝酸银溶液鉴别稀盐酸和稀硫酸 D、用燃着的木条鉴别氢气、氧气和二氧化碳6. 下列各组物质分别加入足量的水中,能得到无色透明溶液的是( )A、FeCl3、NaOH、NaCl B、AgNO3、NaCl、BaCl2 C、CuSO4、NaCl 、HCl D、Na2CO3、NaCl、Na2SO47. 下图是无色溶液X发生化学反应时的颜色变化,无色溶液X是( ) A、稀盐酸 B、稀硫酸 C、澄清石灰水 D、硫酸钠溶液8. 某班甲、乙两组同学分别做常见酸和碱与指示剂反应的实验,使用的试剂有稀盐酸、稀硫酸、氢氧化钠溶液和酚酞试液。实验后废液分别集中到各组的一个废液缸中。研究小组对两个组的废液进行检测,结果如下表。下列说法正确的是( )
A、稀盐酸 B、稀硫酸 C、澄清石灰水 D、硫酸钠溶液8. 某班甲、乙两组同学分别做常见酸和碱与指示剂反应的实验,使用的试剂有稀盐酸、稀硫酸、氢氧化钠溶液和酚酞试液。实验后废液分别集中到各组的一个废液缸中。研究小组对两个组的废液进行检测,结果如下表。下列说法正确的是( ) A、甲组废液中一定含有稀盐酸或稀硫酸 B、乙组废液中一定含有氢氧化钠、氯化钠、硫酸钠 C、甲组废液可直接排放,乙组处理后再排放 D、如将两组的废液合并在一起,如溶液呈无色,混合液可直接排放。9. 我国科学家在甲烷高效转化研究中获得重大突破,如图为该转化的微观示意图。下列说法正确的是( )
A、甲组废液中一定含有稀盐酸或稀硫酸 B、乙组废液中一定含有氢氧化钠、氯化钠、硫酸钠 C、甲组废液可直接排放,乙组处理后再排放 D、如将两组的废液合并在一起,如溶液呈无色,混合液可直接排放。9. 我国科学家在甲烷高效转化研究中获得重大突破,如图为该转化的微观示意图。下列说法正确的是( )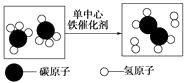 yA、该反应属于分解反应 B、一个甲烷分子中有四个氢元素 C、甲烷中碳、氢元素质量比为1∶4 D、单中心铁催化剂改变了反应速率,反应后本身质量减少10. 实验室发现一瓶标签脱落的固体试剂,小王分别取少量的该固体进行了下列实验。根
yA、该反应属于分解反应 B、一个甲烷分子中有四个氢元素 C、甲烷中碳、氢元素质量比为1∶4 D、单中心铁催化剂改变了反应速率,反应后本身质量减少10. 实验室发现一瓶标签脱落的固体试剂,小王分别取少量的该固体进行了下列实验。根据实验现象,该固体最可能是( )
实验步骤
实验现象
检测水中加入固体前后液体的pH
固体不溶解,液体的pH几乎没变化
检测盐酸中加入固体前后溶液的pH
固体溶解,无气体放出,溶液pH增大
固体灼热状态下,通入纯净CO
固体质量减轻,尾气中只检测到CO与CO2
A、金属单质 B、碱 C、盐 D、金属氧化物11. 科学老师介绍世界上的最强溶剂“王水”(浓盐酸与浓硝酸的混合液),可以溶解黄金的事例引起了同学们的热议。黄金溶解在“王水”中形成HAuCl4(四氯合金酸),没有氢气产生。根据以上信息,下列有关说法正确的是( )①“王水”溶解黄金是化学变化; ②金比氢活泼; ③HAuCl4中,Au的化合价为+3价;④可以将pH试纸伸入“王水”中测其酸碱度;
A、①④ B、①②③ C、③④ D、①③12. 逻辑推理是化学学习中常用的思维方法。下列推理结果正确的是 ( )A、酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应 B、氧化物中都含有氧元素,则含有氧元素的化合物一定是氧化物 C、碱溶液的pH >7,则pH >7的溶液一定是碱的溶液 D、点燃H2和O2的混合气体可能发生爆炸,则H2点燃前须检验纯度13. 亚硝酸钠外观酷似食盐,有咸味,加热会分解,放出有臭味的气体。请结合下表信息判断,下列区别亚硝酸钠和氯化钠的方法错误的是( )亚硝酸钠(NaNO2)
氯化钠(NaCl)
跟稀盐酸作用
放出红棕色的气体
无反应
跟硝酸银溶液作用
生成浅黄色沉淀
生成白色沉淀
A、滴加稀盐酸 B、加热 C、滴加硝酸银溶液 D、加水溶解14. 在一定质量的甲溶液中逐渐加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系,能用右下图曲线表示的是( )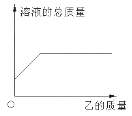
序号
甲
乙
A
HCl溶液
NaOH溶液
B
HCl溶液
大理石
C
BaCl2溶液
Na2CO3溶液
D
CuSO4溶液
铁 粉
A、A B、B C、C D、D15. 在反应X+2Y→R+2M中,已知R和M的相对分子质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR。则在此反应中Y和M的质量之比为 ( )A、16:9 B、23:9 C、32:9 D、46:9二、填空题
-
16. 如下图是实验室的部分仪器或实验装置,回答有关问题。
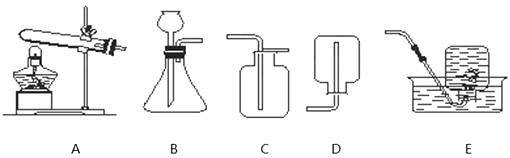 (1)、双氧水制氧气的原理:(2)、实验室要用KClO3和MnO2制取氧气,应选用发生装置是 (填编号),若用排水法收集氧气,收集完毕后,应先。(选填“撤离导管”或“熄灭酒精灯”)(3)、装满氧气的集气瓶应盖上玻璃片后,(选填“正放”或“倒放”)在桌面上,其验满的操作方法是。17. 自来水厂净水过程中用到活性炭,其作用是。净水过程中常用液氯(Cl2)作消毒剂,液氯注入水后发生反应的微观示意图如下:
(1)、双氧水制氧气的原理:(2)、实验室要用KClO3和MnO2制取氧气,应选用发生装置是 (填编号),若用排水法收集氧气,收集完毕后,应先。(选填“撤离导管”或“熄灭酒精灯”)(3)、装满氧气的集气瓶应盖上玻璃片后,(选填“正放”或“倒放”)在桌面上,其验满的操作方法是。17. 自来水厂净水过程中用到活性炭,其作用是。净水过程中常用液氯(Cl2)作消毒剂,液氯注入水后发生反应的微观示意图如下:
写出上述反应的化学方程式 , 分析该反应前后,化合价发生改变的元素是。
18. 小明同学用如下实验装置探究CO2与NaOH溶液能否反应。锥形瓶中的溶液为氢氧化钠溶液或澄清石灰水(均为200mL)。
【查阅资料】
①通常状况下,1体积水能溶解1体积二氧化碳;
②CO2在酸性溶液中溶解性会大大降低,若向溶有CO2的水溶液中加入盐酸, 会将CO2从水中赶出,观察到溶液中有气泡。
(1)、小明向A装置通入的CO2气体体积V应200mL(填“>”、“<”或“=”)。(2)、A中的溶液是 , B中的溶液是 , 证明氢氧化钠溶液可以与二氧化碳反应的现象是。(3)、小红不用B装置,实验后他向锥形瓶A中的溶液中加入盐酸溶液发现有气泡产生,他判断该现象能证明二氧化碳和氢氧化钠溶液反应,你认为他的判断是否正确。小丽也不用B装置,实验后她向锥形瓶A中的溶液中加入氯化钙溶液,如出现 , 就能证明二氧化碳和氢氧化钠溶液反应。并写出相关化学方程式。19. 根据下图三个化学实验,回答问题: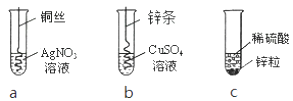 (1)、描述实验a中的实验现象。(2)、要证明Cu、Zn、Ag的活动性顺序,必须要做的实验是(填实验序号)。(3)、在c实验后的剩余溶液中,一定有的溶质是 , 可能有的溶质是 , 为了确定可能有的溶质,可加入
(1)、描述实验a中的实验现象。(2)、要证明Cu、Zn、Ag的活动性顺序,必须要做的实验是(填实验序号)。(3)、在c实验后的剩余溶液中,一定有的溶质是 , 可能有的溶质是 , 为了确定可能有的溶质,可加入A.氯化钡溶液 B.氢氧化铜 C.氢氧化钠溶液 D.锌粒
三、实验探究题
-
20. 化学兴趣小组同学发现实验台上按如图所示顺序摆放着6瓶不同的无色溶液(如图所示:A、B、C、D、E、F代表对应的溶液).其中E溶液的试剂瓶标签破损.为此,他们做了如下探究:
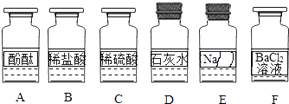
【提出问题】E溶液的成分是什么?
【提出猜想】Ⅰ:NaOH溶液; Ⅱ:Na2CO3溶液;
Ⅲ:Na2SO4溶液; Ⅳ:NaCl溶液
【验证猜想】按如下步骤进行
步骤一
步骤二
步骤三
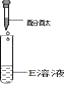
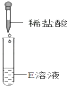

【分析与推理】
(1)、步骤一中如出现红色,李成同学即认为“猜想Ⅰ”正确,张平同学认为“猜想Ⅰ”不一定正确,他的理由是 。你认为步骤三( 填“可省去”或“不可省去”)就可得出结论。如果判断出溶液是NaOH溶液,则依据的实验现象是。(2)、步骤一中如没有出现红色,你认为上述的(填“步骤二”或“步骤三”)不可以省略,其中发生的化学反应属于反应(填反应类型)。【反思与评价】最终判断出E瓶是NaOH溶液。张平同学认为D、E试剂瓶都需要密封保存。请用化学方程式来说明D瓶需要密封保存的原因。
21. 为了将氯化钠和氯化钙的混合物分离,并测定其中氯化钠的质量分数,兴趣小组最初设计了如下方案并进行实验:
根据流程图回答:
(1)、沉淀B化学式是 , 试剂甲是 , 滤液C中溶质成分有。(2)、根据以上方案得到NaCl固体测定含有杂质,同学们通过分析后对上述方案作出改进:在步骤Ⅴ滤液C蒸发结晶之前,先滴加足量的 , 既能除去所含杂质,又能有效防止新杂质的引入,上述反应的化学方程式为。(3)、为测定原混合物中氯化钠的质量分数,同学们提出了如下两个数据测定方案。方案1:称量混合物A的总质量和干燥的沉淀B或CaCl2固体的质量,并进行计算;
方案2:称量混合物A的总质量和实验改进后所得纯净氯化钠固体的质量,并进行计算。
请你判断:上述所选称量数据不合理的是(填:“方案1”或“方案2”)。
理由是。
22. 工业上用电解饱和食盐水的方法制取氢氧化钠。反应原理是2NaCl+2H2O H2↑+Cl2↑+2NaOH。(1)、该实验中正极产生的气体呈黄绿色,具有剌激性气味,该气体是(填“H2”或“Cl2”)。向电解后的溶液中滴加硫酸铜溶液,可观察到的现象是 , 证明反应生成了氢氧化钠。(2)、电解食盐水时,若有11.7gNaCl参加反应,生成氢氧化钠的质量是g。四、分析计算题
-
23. 汽泡爽是一种冲调饮料。其主要原料为柠檬酸(C6H8O7)和小苏打(NaHCO3);使用时将一包汽泡爽粉末倒入玻璃杯中,加入200 mL冷水,看到有大量气泡快速生成,待粉末完全溶解,就得到一杯果味饮料。(1)、小苏打(NaHCO3),从组成上看,它属于一种______。A、酸 B、碱 C、盐 D、氧化物(2)、一个柠檬酸分子(C6H8O7)是由个原子组成,(3)、该物质中碳元素的质量分数为。24. 黄铁矿矿石的主要成分为二硫化亚铁(FeS2)。取一块质量为30 g的黄铁矿矿石样品在氧气中完全灼烧后,得到10 g氧化铁(其中的铁全来自二硫化亚铁),同时生成二氧化硫。(1)、二硫化亚铁中硫元素的化合价为。(2)、写出二硫化亚铁在氧气中完全灼烧的化学方程式(3)、计算黄铁矿矿石样品中二硫化亚铁的质量分数。25. 小明为了测定某钙片中碳酸钙的质量分数,用如图所示装置进行如下实验。

①取研碎后的钙片4g,倒入气密性良好的锥形瓶中,然后在分液漏斗中加入适量的稀盐酸,置于电子天平上测出装置总质量;
②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量;
③整理相关数据如下表,计算出钙片中碳酸钙的质量分数。(该实验中,装置中的固态干燥剂能吸水但不吸收二氧化碳)
反应前总质量/g
275.58
反应后总质量/g
274.92
反应前后质量差/g
0.66
容器内气体质量差/g
m
(1)、反应前容器内是空气(密度为ρ1),反应后全部是二氧化碳(密度为ρ2),则反应前后容器(容积为V)内的气体质量差m为。(用字母表示,反应物的体积忽略不计)(2)、小明查阅有关数据后,计算出反应前后容器内的气体质量差m为0.22g,结合表中数据,计算该钙片中碳酸钙的质量分数。(钙片中的其他成分不与盐酸反应)26. 现有一包Na2CO3和Na2SO4固体粉末混合物22.2g,向其中加入足量的稀H2SO4 , 产生气体的质量和加入稀H2SO4的质量关系如图所示。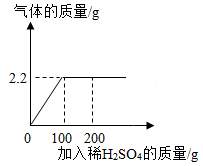 (1)、产生气体的质量为g;(2)、恰好完全反应时,求所用稀H2SO4中溶质的质量;(3)、求恰好完全反应时溶液中溶质的质量分数。27. 用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置。准确称取15g干燥样品进行实验。
(1)、产生气体的质量为g;(2)、恰好完全反应时,求所用稀H2SO4中溶质的质量;(3)、求恰好完全反应时溶液中溶质的质量分数。27. 用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置。准确称取15g干燥样品进行实验。 (1)、该实验中,装置乙的作用是(2)、准确称取完全反应前后装置丙和丁的质量如表:
(1)、该实验中,装置乙的作用是(2)、准确称取完全反应前后装置丙和丁的质量如表:装置丙
装置丁
反应前
48.8g
161.2g
反应后
46.5g
163.9g
小明根据装置丙减少的质量就是氧元素质量,求得氧化铜的质量为g,氧化铜的纯度为%。
(3)、小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度。(写出计算过程)(4)、比较小明和小丽的计算结果,请分析导致这一结果的原因可能是______。A、装置的气密性不好 B、空气中的水分被丁处浓硫酸吸收 C、通入的氢气量不足 D、空气中的二氧化碳被丁处浓硫酸吸收