江西省新建一中2020-2021学年高一下学期化学开学考试试卷
试卷更新日期:2021-03-30 类型:开学考试
一、单选题
-
1. NA表示阿伏加德罗常数的值,下列说法中正确的是( )A、含0.1mol BaCl2的溶液中Cl-数为0.1NA B、22gCO2所含有的分子数为0.5NA C、11.2LCO2所含有的分子数为0.5NA D、常温下NA个Cl2分子所占有的体积为22.4L2. 下列存在因果关系或能达到目的的是( )
选项
目的或叙述
操作或叙述
A
KNO3的溶解度大
用重结晶法除去KNO3中混有的NaCl
B
BaSO4难溶于酸
用盐酸和BaCl2溶液检验SO42-
C
原溶液中有SO42-
滴加BaCl2溶液,生成白色沉淀
D
某钾盐是K2CO3
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体
A、A B、B C、C D、D3. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、使石蕊变红色的溶液:Mg2+、K+、 、 B、使酚酞变红色的溶液:Na+、Cu2+、 、 C、0.1 mol·L-1AgNO3溶液:H+、K+、 、Cl- D、0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、4. 现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应,已知Na2SO3可被K2Cr2O7氧化为Na2SO4 , 则元素Cr在还原产物中的化合价为( )A、+2 B、+3 C、+4 D、+55. 甲、乙两个烧杯中分别盛有100 mL 4.0 mol·L-1的盐酸和100 mL 4.0 mol·L-1NaOH溶液,向两个烧杯中均加入5.4 g铝粉,在相同状况下产生气体的体积比为( )A、1∶1 B、2∶3 C、3∶2 D、3∶16. 关于 Na2CO3 和 NaHCO3 性质的说法错误的是( )A、热稳定性:NaHCO3<Na2CO3 B、与同浓度盐酸反应的剧烈程度:NaHCO3<Na 2CO3 C、相同温度时,在水中的溶解性:NaHCO3<Na2CO3 D、等物质的量的 Na2CO3、NaHCO3 分别与足量盐酸反应产生的 CO2 质量相同7. 下列说法或装置错误的是( ) A、制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 B、按如图所示进行碳酸氢钠受热分解实验 C、小苏打是面包发酵粉的主要成分之一 D、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO +2H2O=Al(OH)3↓+HCO8. 某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如下图所示:
A、制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 B、按如图所示进行碳酸氢钠受热分解实验 C、小苏打是面包发酵粉的主要成分之一 D、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO +2H2O=Al(OH)3↓+HCO8. 某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如下图所示:
现对A、B、C、D做出的如下推断中,错误的是( )
A、A盐一定是FeCl3 B、白色沉淀B可能是AgCl C、C中一定含Fe3+ D、无法确定A中是否含有Fe2+9. 如图装置用来检验氯气的部分性质,下列说法错误的是( ) A、装置A的作用是除去氯气中的水蒸汽 B、该实验必须在通风橱中进行 C、装置C中发生反应为Cl2+2NaOH=NaCl+NaClO+H2O D、装置B的现象是干燥处布条褪色,湿润处布条不褪色10. 工业上可利用如下反应检查输送氯气的管道是否漏气:3Cl2+8NH3=N2+6NH4Cl(反应中产生的白烟为NH4Cl小颗粒)。下列有关该反应的说法中,错误的是( )A、属于置换反应 B、Cl2表现强氧化性 C、氧化剂和还原剂的物质的量之比为3∶8 D、生成1molN2 , 有6mol电子转移11. 已知 与浓盐酸在常温下能反应产生 。若用如图所示的实验装置来制备纯净、干燥的氯气,并与金属反应。每个虚线框表示一个单元装置,其中有错误的是( )
A、装置A的作用是除去氯气中的水蒸汽 B、该实验必须在通风橱中进行 C、装置C中发生反应为Cl2+2NaOH=NaCl+NaClO+H2O D、装置B的现象是干燥处布条褪色,湿润处布条不褪色10. 工业上可利用如下反应检查输送氯气的管道是否漏气:3Cl2+8NH3=N2+6NH4Cl(反应中产生的白烟为NH4Cl小颗粒)。下列有关该反应的说法中,错误的是( )A、属于置换反应 B、Cl2表现强氧化性 C、氧化剂和还原剂的物质的量之比为3∶8 D、生成1molN2 , 有6mol电子转移11. 已知 与浓盐酸在常温下能反应产生 。若用如图所示的实验装置来制备纯净、干燥的氯气,并与金属反应。每个虚线框表示一个单元装置,其中有错误的是( ) A、①处和②处 B、只有②处 C、只有②处和③处 D、②处、③处和④处12. 以下有关氨及铵盐的叙述中错误的是( )A、铵态氮肥不能与碱性物质如草木灰混合施用 B、氨的喷泉实验体现了氨的溶解性和氧化性 C、实验室常用固体氯化铵与氢氧化钙反应制取氨气 D、氨具有还原性,一定条件下可与氧化性物质如氧气发生反应13. 下列叙述正确的是( )A、浓硫酸是一种干燥剂,能够干燥氢气、氧气等气体,但不能干燥碱性气体和有较强还原性的HI、H2S等气体 B、浓硫酸与单质碳反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性 C、把足量铜粉投入到含2 mol H2SO4的浓硫酸中,加热得到气体体积标准状况下为22.4 L D、常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸与其不反应14. 下列装置所示的实验中,能达到实验目的是( )A、
A、①处和②处 B、只有②处 C、只有②处和③处 D、②处、③处和④处12. 以下有关氨及铵盐的叙述中错误的是( )A、铵态氮肥不能与碱性物质如草木灰混合施用 B、氨的喷泉实验体现了氨的溶解性和氧化性 C、实验室常用固体氯化铵与氢氧化钙反应制取氨气 D、氨具有还原性,一定条件下可与氧化性物质如氧气发生反应13. 下列叙述正确的是( )A、浓硫酸是一种干燥剂,能够干燥氢气、氧气等气体,但不能干燥碱性气体和有较强还原性的HI、H2S等气体 B、浓硫酸与单质碳反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性 C、把足量铜粉投入到含2 mol H2SO4的浓硫酸中,加热得到气体体积标准状况下为22.4 L D、常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸与其不反应14. 下列装置所示的实验中,能达到实验目的是( )A、 分离碘和酒精
B、
分离碘和酒精
B、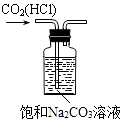 除去CO2中的HCl
C、
除去CO2中的HCl
C、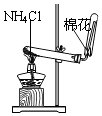 实验室制氨气
D、
实验室制氨气
D、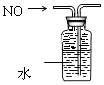 排水法收集NO
15. 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是()
排水法收集NO
15. 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是()
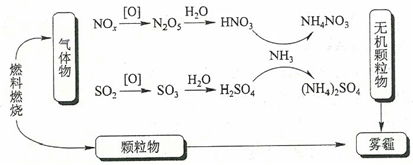
A、雾和霾的分散剂相同 B、雾霾中含有硝酸铵和硫酸铵 C、NH3是形成无机颗粒物的催化剂 D、雾霾的形成与过度施用氮肥有关16. 将19.2 g Cu溶于100 mL浓度均为1 mol·L-1的HNO3和H2SO4的混合溶液中,若产生的气体为NO,则产生的NO在标准状况下的体积为( )A、2.24 L B、1.68 L C、3.36 L D、1.12 L二、非选择题
-
17. 某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一)碘含量的测定

实验(二)碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)、实验(一)中的仪器名称:仪器A , 仪器B。(2)、①步骤X中,萃取后分液漏斗内观察到的现象是。②下列有关步骤Y的说法,正确的是。
A. 应控制NaOH溶液的浓度和体积
B. 将碘转化成离子进入水层
C. 主要是除去海带浸取原液中的有机杂质
D. NaOH溶液可以由乙醇代替
③实验(二)中操作Z的名称是。
18. 某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L-1 FeCl3溶液,0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。(1)、用所给试剂写出体现Fe2+具有还原性的反应的化学方程式。(2)、设计实验方案,完成下列表格。探究内容
实验方案
实验现象
探究Fe3+具有氧化性
取少量0.1 mol·L-1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液
加入铁粉后,溶液颜色变为浅绿色。加入KSCN溶液后,溶液
(3)、该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为。(4)、某反应中反应物与生成物有Fe3+、Mn2+、H+、MnO 、H2O和一种未知离子X,已知MnO 在反应中得到电子,则X离子是。19. 某学习小组为了模拟工业上氨氧化制硝酸,用下列仪器进行实验:
C装置可以加热,回答下列问题:
(1)、NH3催化氧化的方程式为。(2)、装置图中虚线方框内必要仪器的名称和所盛试剂分别为。(3)、A处的玻璃导管设置成可上下抽动的原因。(4)、实验中在D中观察到的实验现象是。(5)、E的作用是。20. 在一定温度下,KClO3和浓盐酸反应会生成黄绿色的易爆物二氧化氯(ClO2),反应的化学方程式为:(1)、配平化学方程式KClO3+HCl(浓)=KCl+ClO2↑+Cl2↑+H2O。(2)、在该反应中HCl表现的性质是。(3)、在反应中产生0.1 mol Cl2时,转移电子的物质的量为mol。(4)、ClO2具有很强的氧化性,可被用来作自来水的消毒剂。若ClO2作消毒剂后转化为Cl- , 则其消毒的效率(以单位物质的量得到的电子数表示)是Cl2的倍。21. 人们认识和应用物质常从两方面入手,一是从物质的类别认识该物质可能跟哪些物质发生反应;二是从物质所含元素的化合价分析该物质是否具有氧化性或还原性。如图所示是硫元素的各个价态与物质类别的对应关系: (1)、写出指定物质的化学式:
(1)、写出指定物质的化学式:A , B。
(2)、D转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式。(3)、若C是铜盐,试写出由H2SO4→C的化学方程式。(4)、为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。写出该反应的化学方程式。