浙江省名校协作体2020-2021学年高三下学期化学开学考试试卷
试卷更新日期:2021-03-30 类型:开学考试
一、单选题
-
1. 水溶液呈碱性的是( )A、NaHSO4 B、CuSO4 C、NaHCO3 D、CH3COONH42. 配制500mL的0.100mol·L-1NaCl溶液,需要用到的仪器是( )A、
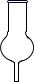 B、
B、 C、
C、 D、
D、 3. 下列物质熔融状态时不导电的是( )A、MgF2 B、KCl C、H2SO4 D、NaOH4. 下列物质名称正确的是( )A、Na2O·CaO·6SiO2 硅藻土 B、Na2CO3·10H2O 小苏打 C、(NH4)2Fe(SO4)2·6H2O 摩尔盐 D、CH3OH 酒精5. 下列说法正确的是( )A、乙烯的键线式:
3. 下列物质熔融状态时不导电的是( )A、MgF2 B、KCl C、H2SO4 D、NaOH4. 下列物质名称正确的是( )A、Na2O·CaO·6SiO2 硅藻土 B、Na2CO3·10H2O 小苏打 C、(NH4)2Fe(SO4)2·6H2O 摩尔盐 D、CH3OH 酒精5. 下列说法正确的是( )A、乙烯的键线式: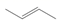 B、H2O的球棍模型:
B、H2O的球棍模型:  C、羟基的电子式:
C、羟基的电子式: 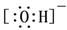 D、乙醇的最简式:CH3O
6. 下列说法错误的是( )A、德国化学家维勒在制备NH4CNO时得到了尿素 B、甲醇在能源工业领域有很好的应用前景,甲醇燃料电池能实现污染物的“零排放” C、可燃冰的主要成分是天然气的水合物,易燃烧 D、煤的气化、煤的液化都是物理变化7. 下列说法错误的是( )A、1H、12C和16O是3种不同的核素 B、C60和石墨烯互为同素异形体 C、
D、乙醇的最简式:CH3O
6. 下列说法错误的是( )A、德国化学家维勒在制备NH4CNO时得到了尿素 B、甲醇在能源工业领域有很好的应用前景,甲醇燃料电池能实现污染物的“零排放” C、可燃冰的主要成分是天然气的水合物,易燃烧 D、煤的气化、煤的液化都是物理变化7. 下列说法错误的是( )A、1H、12C和16O是3种不同的核素 B、C60和石墨烯互为同素异形体 C、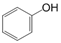 和
和 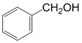 互为同系物
D、环氧乙烷和乙醛互为同分异构体
8. 下列说法正确的是( )A、玻璃试剂瓶不能长时间储存酸性溶液 B、聚乙烯塑料的老化是因为发生了加成反应 C、Al2O3熔点高所以可用作耐腐蚀材料 D、漂白粉溶液可用于环境的消毒杀菌9. 下列说法正确的是( )A、铁表面自然形成的铁锈能保护内层金属不被空气氧化 B、生物柴油是由动植物油脂和短链醇反应得到的,是可再生资源,地沟油不能作为生物柴油的原料 C、古法可用CaSO4、FeSO4、CuSO4的加热分解制硫酸 D、铜氨纤维和光导纤维都是新型无机材料10. 反应3NO2+H2O=2HNO3+NO中,氧化产物与还原产物的物质的量之比是( )A、1∶2 B、2∶1 C、1∶1 D、3∶211. 下列有关实验原理、方法和结论都正确的是( )A、利用纸层析法分离硫酸铁和硫酸铜时,亲脂性成分在固定相中分配的多一些,随流动相移动的速度快一些 B、乙酰水杨酸的合成实验中,抽滤时用少量无水乙醇洗涤结晶几次,继续抽滤,尽量将溶剂抽干 C、室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中的少量苯酚 D、酸或碱对乙酸乙酯的水解都有催化作用,等量的酯在其他条件一致的情况下,用酸或用碱做催化剂,其水解的效果是一样的12. 下列说法错误的是( )A、电解MgCl2溶液,可能生成Mg(OH)Cl沉淀 B、碘单质与KOH溶液反应可得到补碘剂KIO3 C、饱和碳酸钠溶液中通入足量CO2 , 可得到NaHCO3晶体 D、SO2还原FeSO4溶液生成Fe2(SO4)3溶液13. 下列表示对应化学反应的离子方程式正确的是( )A、用Na2S去除废水中的Hg2+:Hg2++ S2- = HgS↓ B、向NaAlO2溶液中通入少量CO2:AlO +CO2+2H2O = Al(OH)3↓+HCO C、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO = Ag++NO↑+H2O D、用铜电极电解饱和食盐水,有橙黄色物质生成:Cu+2H2O Cu(OH)2↓+H2↑14. 下列说法正确的是( )A、二甲醚和2,2-二甲基丙烷的核磁共振谱中都只有一个位置的特征峰 B、棉、麻和尼龙都是重要的纺织产品,其主要成分均是纤维素 C、将氢氧化钠溶液加入蛋白质溶液并加热会产生沉淀,这种现象叫做盐析 D、月饼中的油脂易被氧化,保存时常放入装有硅胶的透气袋15. 利巴韦林对新冠肺炎有较好的疗效,其结构如图所示。下列说法错误的是( )
互为同系物
D、环氧乙烷和乙醛互为同分异构体
8. 下列说法正确的是( )A、玻璃试剂瓶不能长时间储存酸性溶液 B、聚乙烯塑料的老化是因为发生了加成反应 C、Al2O3熔点高所以可用作耐腐蚀材料 D、漂白粉溶液可用于环境的消毒杀菌9. 下列说法正确的是( )A、铁表面自然形成的铁锈能保护内层金属不被空气氧化 B、生物柴油是由动植物油脂和短链醇反应得到的,是可再生资源,地沟油不能作为生物柴油的原料 C、古法可用CaSO4、FeSO4、CuSO4的加热分解制硫酸 D、铜氨纤维和光导纤维都是新型无机材料10. 反应3NO2+H2O=2HNO3+NO中,氧化产物与还原产物的物质的量之比是( )A、1∶2 B、2∶1 C、1∶1 D、3∶211. 下列有关实验原理、方法和结论都正确的是( )A、利用纸层析法分离硫酸铁和硫酸铜时,亲脂性成分在固定相中分配的多一些,随流动相移动的速度快一些 B、乙酰水杨酸的合成实验中,抽滤时用少量无水乙醇洗涤结晶几次,继续抽滤,尽量将溶剂抽干 C、室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中的少量苯酚 D、酸或碱对乙酸乙酯的水解都有催化作用,等量的酯在其他条件一致的情况下,用酸或用碱做催化剂,其水解的效果是一样的12. 下列说法错误的是( )A、电解MgCl2溶液,可能生成Mg(OH)Cl沉淀 B、碘单质与KOH溶液反应可得到补碘剂KIO3 C、饱和碳酸钠溶液中通入足量CO2 , 可得到NaHCO3晶体 D、SO2还原FeSO4溶液生成Fe2(SO4)3溶液13. 下列表示对应化学反应的离子方程式正确的是( )A、用Na2S去除废水中的Hg2+:Hg2++ S2- = HgS↓ B、向NaAlO2溶液中通入少量CO2:AlO +CO2+2H2O = Al(OH)3↓+HCO C、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO = Ag++NO↑+H2O D、用铜电极电解饱和食盐水,有橙黄色物质生成:Cu+2H2O Cu(OH)2↓+H2↑14. 下列说法正确的是( )A、二甲醚和2,2-二甲基丙烷的核磁共振谱中都只有一个位置的特征峰 B、棉、麻和尼龙都是重要的纺织产品,其主要成分均是纤维素 C、将氢氧化钠溶液加入蛋白质溶液并加热会产生沉淀,这种现象叫做盐析 D、月饼中的油脂易被氧化,保存时常放入装有硅胶的透气袋15. 利巴韦林对新冠肺炎有较好的疗效,其结构如图所示。下列说法错误的是( )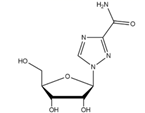 A、利巴韦林水溶性较好,且可以与盐酸反应 B、利巴韦林能够发生还原、加成、取代反应和消去反应 C、1mol利巴韦林能与足量NaOH溶液反应,最多消耗4molNaOH D、利巴韦林的分子式为C8H12N4O516. A、B、C、D、E为五种短周期元素,原子序数依次递增,A2和B2、A2和C2均可发生化合反应,且B、C为同周期相邻元素;B2气体在标准状况下的密度为1.25 g·L-1;D的最外层电子数是3;E原子半径在同周期里是最小的。下列说法正确的是( )A、简单离子半径:E>D>B>C B、B,C的氢化物中所有原子都满足8电子稳定结构 C、C,D的化合物的水化物不能与A,E的化合物反应 D、由A,B,C形成的化合物,可能是离子化合物17. 下列说法正确的是( )A、OH-的浓度增大,溶液的碱性一定增强 B、常温下0.1mol·L-1醋酸溶液的pH=a,将溶液稀释到原体积的10倍能使溶液的pH=(a+1) C、将NaCl溶液从常温加热至80℃,溶液仍保持中性,pH值不变 D、pH=2的硫酸和pH=2的醋酸以体积比1∶10混合后,溶液pH仍为218. 0.1 mol·L-1的银氨溶液中存在如下平衡:Ag(NH3) +2H2O⇌Ag++2NH3·H2O,下列说法正确的是( )A、向溶液中加一定浓度的氨水,该平衡可能正向移动 B、该反应是一个水解反应 C、向溶液中逐滴加入稀盐酸至过量,产生白色沉淀,再加入氢氧化钠沉淀至过量沉淀减少 D、温度升高有利于该反应平衡正向移动,是由于促进了NH3·H2O电离降低了溶液中NH3·H2O浓度19. 设NA为阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,2.24L的乙烯和2.24L的己烯,碳氢键都为0.2mNA , m为烯烃碳原子数 B、25℃,pH=12的NaOH溶液中含有OH-的数目约为0.01NA C、CH3CH2OH+3O2+4OH- = 2CO +5H2O,每消耗1molCH3CH2OH,有12NA电子发生转移 D、2Na2O2+2H2O=4NaOH+O2↑,该反应转移电子数为2NA时,生成0.5mol O220. 关于反应CH3COOH(l) + C2H5OH(l)⇌CH3COOC2H5(l) + H2O(l) ΔH= -2.7kJ·mol-1 , 下列说法正确的是( )A、因为化学反应方程式前后物质的化学计量数之和相等,所以反应的ΔS等于0 B、该反应的平衡常数为: C、加入高效吸水剂有利于平衡正向移动,该反应平衡常数增大 D、因为反应的ΔH接近于0,所以温度变化对平衡转化率的影响不大21. 某种处理废水中NO 的装置如图所示,当该装置工作时,下列说法正确的是 ( )
A、利巴韦林水溶性较好,且可以与盐酸反应 B、利巴韦林能够发生还原、加成、取代反应和消去反应 C、1mol利巴韦林能与足量NaOH溶液反应,最多消耗4molNaOH D、利巴韦林的分子式为C8H12N4O516. A、B、C、D、E为五种短周期元素,原子序数依次递增,A2和B2、A2和C2均可发生化合反应,且B、C为同周期相邻元素;B2气体在标准状况下的密度为1.25 g·L-1;D的最外层电子数是3;E原子半径在同周期里是最小的。下列说法正确的是( )A、简单离子半径:E>D>B>C B、B,C的氢化物中所有原子都满足8电子稳定结构 C、C,D的化合物的水化物不能与A,E的化合物反应 D、由A,B,C形成的化合物,可能是离子化合物17. 下列说法正确的是( )A、OH-的浓度增大,溶液的碱性一定增强 B、常温下0.1mol·L-1醋酸溶液的pH=a,将溶液稀释到原体积的10倍能使溶液的pH=(a+1) C、将NaCl溶液从常温加热至80℃,溶液仍保持中性,pH值不变 D、pH=2的硫酸和pH=2的醋酸以体积比1∶10混合后,溶液pH仍为218. 0.1 mol·L-1的银氨溶液中存在如下平衡:Ag(NH3) +2H2O⇌Ag++2NH3·H2O,下列说法正确的是( )A、向溶液中加一定浓度的氨水,该平衡可能正向移动 B、该反应是一个水解反应 C、向溶液中逐滴加入稀盐酸至过量,产生白色沉淀,再加入氢氧化钠沉淀至过量沉淀减少 D、温度升高有利于该反应平衡正向移动,是由于促进了NH3·H2O电离降低了溶液中NH3·H2O浓度19. 设NA为阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,2.24L的乙烯和2.24L的己烯,碳氢键都为0.2mNA , m为烯烃碳原子数 B、25℃,pH=12的NaOH溶液中含有OH-的数目约为0.01NA C、CH3CH2OH+3O2+4OH- = 2CO +5H2O,每消耗1molCH3CH2OH,有12NA电子发生转移 D、2Na2O2+2H2O=4NaOH+O2↑,该反应转移电子数为2NA时,生成0.5mol O220. 关于反应CH3COOH(l) + C2H5OH(l)⇌CH3COOC2H5(l) + H2O(l) ΔH= -2.7kJ·mol-1 , 下列说法正确的是( )A、因为化学反应方程式前后物质的化学计量数之和相等,所以反应的ΔS等于0 B、该反应的平衡常数为: C、加入高效吸水剂有利于平衡正向移动,该反应平衡常数增大 D、因为反应的ΔH接近于0,所以温度变化对平衡转化率的影响不大21. 某种处理废水中NO 的装置如图所示,当该装置工作时,下列说法正确的是 ( )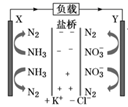 A、盐桥中Cl-向Y电极移动 B、电路中流过7.5mol电子时,共产生标准状况下N2的体积为16.8L C、X电极发生的反应为2NH3-6e-+6OH- =N2+6H2O D、最终可以在Y电极收集到高浓度硝酸钾副产物,可用作氮肥22. 氢氟酸是一种弱酸,可用来刻蚀玻璃。
A、盐桥中Cl-向Y电极移动 B、电路中流过7.5mol电子时,共产生标准状况下N2的体积为16.8L C、X电极发生的反应为2NH3-6e-+6OH- =N2+6H2O D、最终可以在Y电极收集到高浓度硝酸钾副产物,可用作氮肥22. 氢氟酸是一种弱酸,可用来刻蚀玻璃。①HF(aq)+OH-(aq) = F-(aq)+H2O(l) ΔH=a kJ·mol-1
②H3O+(aq)+OH-(aq) = 2H2O(l) ΔH=b kJ·mol-1
③HF(aq)+H2O(l)⇌H3O+(aq)+F-(aq) ΔH=c kJ·mol-1
④F-(aq)+H2O(l)⇌HF(aq)+OH-(aq) ΔH=d kJ·mol-1
已知:a<b<0,下列说法正确的是( )
A、HF的电离过程吸热 B、c=a-b,c<0 C、c>0,d<0 D、d=b+c,d<023. 常温下,下列有关电解质溶液的说法错误的是( )A、相同浓度、相同体积的 CH3COONa和NaBr两溶液,前者的离子总数小 B、pH=11的氨水和pH=3的盐酸等体积混合后c(NH )+c(OH-)<c(Cl-)+c(H+) C、相同浓度、相同体积H2C2O4-NaHC2O4混合溶液c(H+)+c(H2C2O4) = c(Na+)+c(C2O )+c(OH-) D、在1mol·L-1Na2SO3 溶液中,c(SO )+c(HSO )+c(H2SO3) = 1mol·L-124. 已知Na2S2O4(连二亚硫酸钠)是一种重要的化学用品,不溶于乙醇,溶于氢氧化钠溶液,遇少量水发生强烈反应,甚至会引发燃烧,其相关性质说法错误的是( )A、Na2S2O4具有还原性,可用做抗氧化剂 B、Na2S2O4应干燥密封保存在低温处 C、能在空气中反应生成两种新盐:Na2S2O4+O2+H2O = NaHSO3+NaHSO4 , 生成1mol NaHSO4转移电子2mol D、锌粉法是制备Na2S2O4的常用方法,原料为锌粉悬浊液、二氧化硫和氢氧化钠溶液,反应中二氧化硫被还原25. 某固体混合物X,含有FeCl3、SiO2、NaAlO2、NaNO3、NH4Cl、KI中的几种,进行如下实验: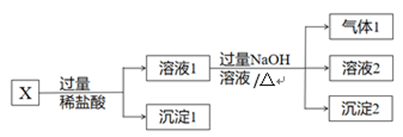
下列说法正确的是( )
A、沉淀2一定是纯净物 B、溶液2中加入苯,振荡、静置后上层无色,则X中没有KI C、X中一定有FeCl3、SiO2、NH4Cl,一定没有NaAlO2 D、取适量溶液1加淀粉溶液,溶液变蓝,则X中没有NaNO3二、填空题
-
26.(1)、比较非金属性强弱:CCl(填“>”、“<”或“=”),用一个化学方程式说明:。(2)、Mg2C3可以和水作用生成丙炔,试写出Mg2C3的电子式。(3)、写出乙醇钠溶液中加入盐酸的化学方程式。27. PCl3和PCl5能发生如下水解反应:PCl3+3H2O = H3PO3+3HCl;PCl5+4H2O = H3PO4+5HCl,现将一定量的PCl3和PCl5混合物溶于足量水中,在加热条件下缓缓通入0.01mol Cl2 , 恰好将H3PO3氧化为H3PO4。往反应后的溶液中加入120mL 2mol·L-1 NaOH溶液,恰好完全中和。计算:(1)、原混合物中PCl3和PCl5的物质的量之比 ;(2)、写出计算过程。28.(1)、I.化学试剂的妥善保存十分重要。共价化合物A由三种常见的短周期元素组成,常温常压下是一种有特殊气味的无色液体,易与强氧化剂反应,实验室必须密封避光保存。按以下流程进行实验(以下反应都为充分反应、气体F溶于水部分忽略不计):

组成A的元素的元素符号为;G的化学式为。
(2)、液体A反应生成B和C的化学方程式为。(3)、保存A时常加入1%的乙醇来破坏A被氧化生成的剧毒物质C。请写出C与乙醇反应生成碳酸二乙酯的化学方程式。(4)、II.Na2S2O3 , 又名大苏打、海波,可用以除去自来水中的多余氯气。在实验室可以用新制氯水模拟含多余氯气的自来水,向新制氯水中滴入Na2S2O3溶液。新制氯水与Na2S2O3溶液反应的离子方程式为。
(5)、新制氯水中的氯气被全部除尽后,如果继续滴入Na2S2O3溶液有可能产生的现象:。29. 二甲醚(CH3OCH3) 是无色气体,可作为一种新型能源。甲醇脱水两步法是目前工业合成二甲醚的主流技术,涉及的反应如下:CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-90.7 kJ·mol-1 ①
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 ②
请回答:
(1)、有利于提高二甲醚产率的措施有______A、高温高压 B、低温低压 C、高温低压 D、低温高压(2)、为了研究CO和H2的最佳投料比,恒温下将1molCO置于恒容密闭容器,改变H2的进料量进行实验,测得平衡时甲醇的体积分数变化如图所示(假设该条件下只发生反应①)。请判断a、b、c三点CO的转化率大小关系,并说明判断依据 (3)、合成二甲醚往往选用硅铝混合物作催化剂。向恒温体系中不断匀速通入甲醇,反应均未达到平衡,不同硅铝比(I、II)与生成二甲醚的速率关系如图所示:
(3)、合成二甲醚往往选用硅铝混合物作催化剂。向恒温体系中不断匀速通入甲醇,反应均未达到平衡,不同硅铝比(I、II)与生成二甲醚的速率关系如图所示:
①在0~30min内,不同催化剂下二甲醚的产量大小关系为:III(填“>”、“<”或“=”)。
②工业上选择适合的硅铝比为0.15,说明其原因
(4)、在某温度下,向密闭容器中加入CH3OH发生反应②,反应到t1时刻测得各组分的浓度分别为:c(CH3OH)=0.47 mol·L-1、c(CH3OCH3)=1.2 mol·L-1 、c(H2O)=1.2 mol·L-1 , t2时刻反应达到平衡。已知反应②在该温度下的平衡常数为400,请在图中画出t1~t2内,c(CH3OCH3)的变化曲线。 30. 草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物、SiO2、CaO等,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
30. 草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物、SiO2、CaO等,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):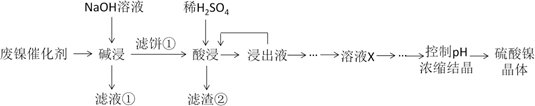
已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Ni2+
Al3+
Fe3+
Fe2+
开始沉淀pH
7.2
3.7
2.2
7.5
完全沉淀pH
8.7
4.7
3.2
9.0
②CaF2的溶解度小于CaC2O4
③NiSO4·7H2O易溶于水,难溶于乙醇
回答下列问题:
(1)、“碱浸”中NaOH的作用分别是除去油脂、SiO2和。(2)、由流程中的“浸出液”制备硫酸镍晶体的正确实验步骤是:第1步:取“浸出液”, , 充分反应后过滤,以除去铁元素;
第2步:向所得滤液中 , 充分反应后过滤,得“溶液X”;
第3步: , 充分反应后过滤;
第4步:滤渣用 , 蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
a.加入适量(NH4)2C2O4
b.加入适量NH4F溶液
c.调节滤液的pH>8.7
d.加入足量的H2O2 , 调节溶液pH为3.2~7.2
e.加入足量的氯水,调节溶液pH为3.2~7.2
f.用稍过量硫酸充分溶解后
(3)、下列说法错误的是______A、快速冷却溶液,可以得到细小的晶体颗粒 B、滤饼①中主要含有Fe、Ni两种金属单质 C、碱浸后抽滤得到滤饼①,该操作过程中需先微开水龙头,让滤纸紧贴布氏漏斗上 D、将分离出硫酸镍晶体后的母液收集、循环使用,其意义是提高镍的回收率(4)、将得到的硫酸镍晶体溶解后加入(NH4)2C2O4进行“沉镍”工序,得到的混合物过滤,用乙醇洗涤、110℃下烘干,得到NiC2O4·2H2O ,实验测定产品中NiC2O4·2H2O含量为100.8%,NiC2O4·2H2O产品中可能混有的物质是 。31. 物质X是合成抗凝血药物利伐沙班的中间体,其合成路线如图所示(部分反应条件省略):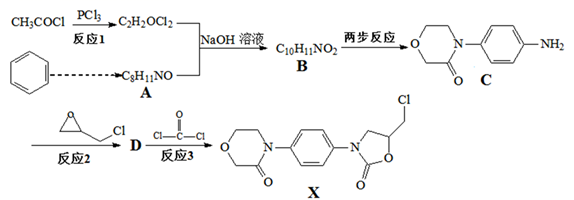
已知:①

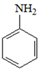
②RNH2
 RNHCH2CH2OH
RNHCH2CH2OH请回答:
(1)、化合物B的结构简式为。(2)、已知A中有两种官能团,其中一种含有氧元素。该官能团名称为。(3)、下列说法正确的是______A、反应1为取代反应 B、化合物D既能发生加成反应,又能发生消去反应 C、化合物X的化学式为C14H14N2O4Cl D、反应3生成1mol化合物X的同时生成了1mol HCl(4)、写出反应2的化学方程式。(5)、写出符合下列条件的化合物A的所有同分异构体:①遇FeCl3溶液显紫色。
②核磁共振氢谱显示有4种不同化学环境的氢原子。
(6)、根据题给信息,设计由 和
和  为原料来合成化合物A的路线 (用流程图表示,其它无机试剂任选)。
为原料来合成化合物A的路线 (用流程图表示,其它无机试剂任选)。