辽宁省丹东市2020-2021学年高三下学期化学开学考试试卷
试卷更新日期:2021-03-30 类型:开学考试
一、单选题
-
1. 2019年,中国研发的“双曲线一号”火箭在酒泉发射升空;2020年,中国“奋斗者”号载人潜水器成功进行深海科考活动。下列说法正确的是( )A、“双曲线一号”火箭中使用的碳纤维树脂复合材料可同时满足耐高温、化学稳定性高等特殊需求 B、制造潜水器载人球舱的钛合金比纯金属钛具有更高的强度、韧性和熔点 C、“奋斗者”号返回水面的浮力材料纳米级玻璃微珠可产生丁达尔效应 D、“奋斗者”号使用的深海水下超高压光纤微缆属于新型有机高分子材料2. 下列关于元素化合物的化学用语错误的是( )A、单线桥表示电子转移:
 B、水的结构式:
B、水的结构式: 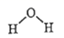 C、硝基苯的结构简式:
C、硝基苯的结构简式:  D、醛基的电子式:
D、醛基的电子式: 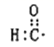 3. LDFCB是电池的一种电解质,该电解质阴离子由同周期元素原子W、X、Y、Z构成(如图),Y的最外层电子数等于X的核外电子总数,四种原子最外层电子数之和为20,下列说法正确的是( )
3. LDFCB是电池的一种电解质,该电解质阴离子由同周期元素原子W、X、Y、Z构成(如图),Y的最外层电子数等于X的核外电子总数,四种原子最外层电子数之和为20,下列说法正确的是( )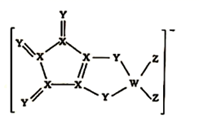 A、四种元素形成的简单氢化物中Z的沸点最高 B、原子半径:Z>Y>X>W C、X的杂化方式是sp3 D、电负性:Z>Y>X>W4. 下列化学用语正确的是( )A、碳原子的核外电子轨道表示式:
A、四种元素形成的简单氢化物中Z的沸点最高 B、原子半径:Z>Y>X>W C、X的杂化方式是sp3 D、电负性:Z>Y>X>W4. 下列化学用语正确的是( )A、碳原子的核外电子轨道表示式: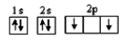 B、第一电离能:O>N>C
C、新戊烷的球棍模型:
B、第一电离能:O>N>C
C、新戊烷的球棍模型:  D、乙炔分子中σ键与π键个数比为1:2
5. 用如图所示实验装置进行相应实验,能达到实验目的的是( )
D、乙炔分子中σ键与π键个数比为1:2
5. 用如图所示实验装置进行相应实验,能达到实验目的的是( )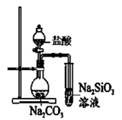
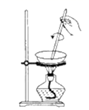
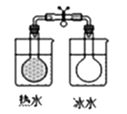
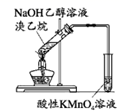
A.推断C、Si、Cl的非金属性强弱
B.灼烧海带以提取海带中的碘
C.探究温度对平衡2NO2 N2O4的影响
D.验证溴乙烷的消去产物是乙烯
A、A B、B C、C D、D6. 磷锡青铜合金广泛用于仪器仪表中的耐磨零件和抗磁元件等。其晶胞结构如图所示。下列说法错误的( )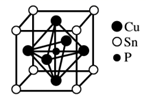 A、磷锡青铜的化学式为Cu3SnP B、该晶胞中与Sn原子等距离且最近的铜原子有12个 C、该晶体的熔点比金刚砂(SiC)的熔点高 D、磷锡青铜具有各向异性的特点7. 在密闭容器中发生储氢反应:LaNi5(s)+3H2(g) LaNi5H6(s) △H=-301kJ•mol-1。在某温度下,达到平衡状态,测得氢气压强为2MPa。下列说法正确的是( )A、当LaNi5H6的浓度不再变化时,该反应达到平衡状态 B、若温度不变,压缩体积至原来的一半,重新达到平衡时H2的压强仍为2MPa C、缩小容器的容积,重新达到平衡时H2的浓度增大 D、升高温度有利于储氢8. 奥司他韦是一种抗病毒药物,常用于治流感,结构如图所示。根据该化合物的结构推测不可能有的性质( )
A、磷锡青铜的化学式为Cu3SnP B、该晶胞中与Sn原子等距离且最近的铜原子有12个 C、该晶体的熔点比金刚砂(SiC)的熔点高 D、磷锡青铜具有各向异性的特点7. 在密闭容器中发生储氢反应:LaNi5(s)+3H2(g) LaNi5H6(s) △H=-301kJ•mol-1。在某温度下,达到平衡状态,测得氢气压强为2MPa。下列说法正确的是( )A、当LaNi5H6的浓度不再变化时,该反应达到平衡状态 B、若温度不变,压缩体积至原来的一半,重新达到平衡时H2的压强仍为2MPa C、缩小容器的容积,重新达到平衡时H2的浓度增大 D、升高温度有利于储氢8. 奥司他韦是一种抗病毒药物,常用于治流感,结构如图所示。根据该化合物的结构推测不可能有的性质( )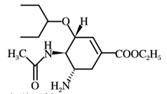 A、奥司他韦能够使溴水和酸性高锰酸钾溶液褪色 B、1mol奥司他韦可与1molH2发生加成反应 C、奥司他韦水解可生成α-氨基酸 D、奥司他韦分子中存在有3个手性碳原子,所以具有光学活性9. 用NA表示阿伏加德罗常数的值,下列说法错误的是( )A、1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液含NH 均为0.5NA B、常温下,10.6gC8H10和C4H10O3的混合物中氢原子数为NA C、2molSO2和1molO2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA D、足量的Cu与含1mol溶质的浓H2SO4反应,转移的电子数小于NA10. 表中的实验、现象和结论均正确的是( )
A、奥司他韦能够使溴水和酸性高锰酸钾溶液褪色 B、1mol奥司他韦可与1molH2发生加成反应 C、奥司他韦水解可生成α-氨基酸 D、奥司他韦分子中存在有3个手性碳原子,所以具有光学活性9. 用NA表示阿伏加德罗常数的值,下列说法错误的是( )A、1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液含NH 均为0.5NA B、常温下,10.6gC8H10和C4H10O3的混合物中氢原子数为NA C、2molSO2和1molO2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA D、足量的Cu与含1mol溶质的浓H2SO4反应,转移的电子数小于NA10. 表中的实验、现象和结论均正确的是( )选项
实验
现象
结论
A
某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
原溶液中含有Fe2+ , 无Fe3+
B
向某溶液中滴加浓NaOH溶液,加热
产生的气体能使湿润的蓝色石蕊试纸变红
原溶液中含有
C
先向某溶液中加入BaCl2溶液,再加足量盐酸
开始产生白色沉淀,后沉淀不溶解
原溶液中含有
D
用洁净的铂丝蘸取某溶液在酒精灯上灼烧,透过钻玻璃观察
火焰呈紫色
原溶液中含有K+
A、A B、B C、C D、D11. 反应I、II、III均会在工业生产硝酸过程中发生,其中反应I、II发生在氧化炉中,反应III发生在氧化塔中,不同温度下各反应的化学平衡常数如表所示。下列说法正确的是( )温度(K)
化学平衡常数
反应I:4NH3+5O2 4NO+6H2O
反应II:4NH3+3O2 2N2+6H2O
反应III:2NO+O2 2NO2
500
1.1×1026
7.1×1014
1.3×102
700
2.1×1019
2.6×1025
1.0
A、升高氧化炉的温度可提高反应I的逆反应速率而减慢反应II的逆反应速率 B、通过减小氧化炉的压强可促进反应I而抑制反应II C、在氧化炉中使用选择性催化反应I的催化剂可增大氧化炉中NO的含量 D、氧化炉出气在进入氧化塔前应进一步提高温度12. 丹东市地处沿海,海洋中有丰富的化学资源,现有一种制取粗碘的工艺流程如图所示,下列有关说法错误的是( )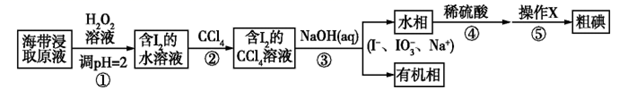 A、步骤②③④为碘的富集过程 B、步骤③④互为可逆反应 C、步骤④中氧化产物与还原产物的质量比为5:1 D、步骤⑤中“操作X”为萃取、分液和蒸馏13. 垃圾假单胞菌株能够在分解有机物的同时分泌物质产生电能,其原理如图所示。下列说法错误的是( )
A、步骤②③④为碘的富集过程 B、步骤③④互为可逆反应 C、步骤④中氧化产物与还原产物的质量比为5:1 D、步骤⑤中“操作X”为萃取、分液和蒸馏13. 垃圾假单胞菌株能够在分解有机物的同时分泌物质产生电能,其原理如图所示。下列说法错误的是( )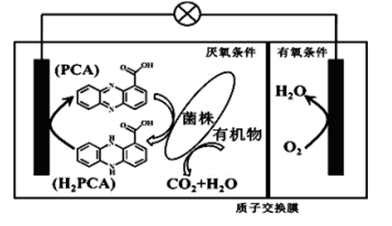 A、电子由左侧电极经过负载后流向右侧电极 B、放电过程中,正极附近pH变大 C、当有4molH+穿过质子交换膜进入左室,消耗标准状况下22.4LO2 D、负极电极反应为:H2PCA-2e-=PCA+2H+14. 常温下,下列说法正确的是( )A、0.1mol/LNH4Cl溶液加水稀释, 减小 B、已知Ka(HA)=1×10-7 , 则0.1mol/LHA溶液中的c(H+)约为1×10-3mol/L C、pH=4的NaHSO3溶液,c(H2SO3)>c(SO ) D、等浓度的下列溶液中c(NH )大小顺序为:(NH4)2SO4>NH4HSO4>NH4Cl15. 常温下,向20.0mL0.10mol/LH2A溶液中滴加0.10mol/LNaOH溶液,溶液的pH和温度随二者体积比的变化曲线如图所示。下列说法正确的是( )
A、电子由左侧电极经过负载后流向右侧电极 B、放电过程中,正极附近pH变大 C、当有4molH+穿过质子交换膜进入左室,消耗标准状况下22.4LO2 D、负极电极反应为:H2PCA-2e-=PCA+2H+14. 常温下,下列说法正确的是( )A、0.1mol/LNH4Cl溶液加水稀释, 减小 B、已知Ka(HA)=1×10-7 , 则0.1mol/LHA溶液中的c(H+)约为1×10-3mol/L C、pH=4的NaHSO3溶液,c(H2SO3)>c(SO ) D、等浓度的下列溶液中c(NH )大小顺序为:(NH4)2SO4>NH4HSO4>NH4Cl15. 常温下,向20.0mL0.10mol/LH2A溶液中滴加0.10mol/LNaOH溶液,溶液的pH和温度随二者体积比的变化曲线如图所示。下列说法正确的是( )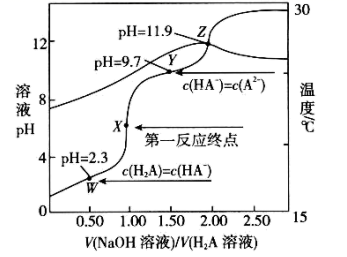 A、常温下,H2A的电离常数Ka1=10-2.3 B、当 =1.50时,3c(Na+)=2c(H2A)+2c(HA-)+2c(A2-) C、从W至Z点对应的溶液中,水的电离程度及Kw均不断增大 D、在X点时,c(OH-)-c(H+)=0.1mol/L-c(HA-)-2c(A2-)
A、常温下,H2A的电离常数Ka1=10-2.3 B、当 =1.50时,3c(Na+)=2c(H2A)+2c(HA-)+2c(A2-) C、从W至Z点对应的溶液中,水的电离程度及Kw均不断增大 D、在X点时,c(OH-)-c(H+)=0.1mol/L-c(HA-)-2c(A2-)二、综合题
-
16. 以软锰矿(主要成分MnO2 , 还含有Fe2O3、Al2O3、CaO、ZnO、SiO2)为原料生产纳米Mn3O4的工艺流程如图:
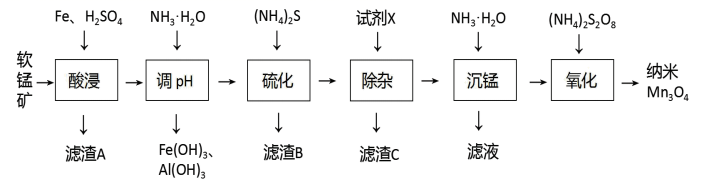
I.难溶物的Ksp如表:
物质
Fe(OH)3
Al(OH)3
Mn(OH)2
Zn(OH)2
ZnS
MnS
CaF2
Ksp
4.0×10-38
4.5×10-33
1.9×10-13
2.0×10-15
1.6×10-24
2.5×10-13
4.0×10-11
II.Mn(OH)2+xNH3=[Mn(NH3)x]2++2OH-
回答下列问题:
(1)、基态锰原子价层电子排布式为 , 已知Mn3O4可与盐酸反应生成氯气(原理同MnO2),写出该反应离子方程式。(2)、软锰矿“酸浸”需要控制温度为90℃左右,其主要成分发生反应的化学方程式为 , “滤渣A”主要成分为。(3)、“硫化”后的滤液中c(Ca2+)=1.0×10-3mol/L,若要将其沉淀完全,则至少需要加入CaF2至溶液中的c(F-)=mol/L。(4)、“沉锰”过程中研究pH与Mn2+的沉降率关系见表,根据表格数据分析,应调节最佳pH为 , 分析其原因为。pH
氨水体积/mL
残余率/%
沉降率/%
8.5
2.7
71.1
28.9
9.0
4.5
45.2
54.8
9.5
7.6
20.5
79.5
10.0
10.5
16.3
83.7
10.5
16.1
18.4
81.6
三、实验题
-
17. 亚硝酰氯(ClNO)可用于合成清洁剂、触媒剂,也是有机合成中的重要试剂。亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色。ClNO可由NO与纯净的Cl2在常温常压下合成,相关实验装置如图所示。
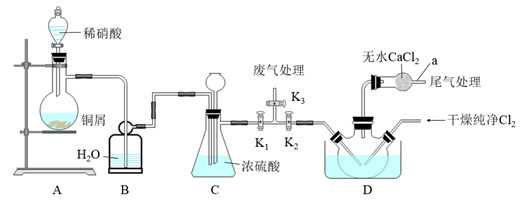
回答下列问题:
(1)、ClNO分子中各原子均满足8电子稳定结构,则ClNO的电子式为。(2)、装置B的作用是 , 若去掉仪器a,则D中亚硝酰氯可能发生反应的化学方程式为。(3)、装置D中水槽内盛有的物质是 (填“冷水”、“冰水混合物”或“冰盐混合物”)。(4)、欲收集一瓶干燥的氯气,制备装置如图所示,其连接顺序为:a→(按气流方向,用小写字母表示)。 (5)、通过以下实验测定ClNO样品的纯度。取D中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20mol•L-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用(填“K2CrO4溶液”、“KI溶液”或“K2S溶液”)做指示剂。
(5)、通过以下实验测定ClNO样品的纯度。取D中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20mol•L-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用(填“K2CrO4溶液”、“KI溶液”或“K2S溶液”)做指示剂。物质
Ag2CrO4
AgCl
AgI
Ag2S
颜色
砖红色
白色
黄色
黑色
Ksp
1×10-12
1.56×10-10
8.3×10-17
6.3×10-50
消耗标准AgNO3溶液的体积为20.00mL,亚硝酰氯(ClNO)的质量分数为。(保留三位有效数字)
四、原理综合题
-
18. 2019年全球二氧化碳排放量预计增幅为0.6%,低于2017年的1.5%,以及2018年的2.1%,增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。(1)、一种途径是用CO2转化为成为有机物实现碳循环。如:
C2H4(g)+H2O(l) C2H5OH(l) △H=-44.2kJ•mol-1
2CO2(g)+2H2O(l) CH4(g)+3O2(g) △H=+1411.0kJ•mol-1
已知2CO2(g)+3H2O(l) C2H5OH(l)+3O2(g)其逆反应的活化能为EakJ•mol-1 , 则正反应的活化能为kJ•mol-1。
(2)、利用工业废气中的CO2可以制取气态甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2 , 在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
①三个反应中活化能最低的是(填“反应I”,“反应II”,“反应III”)。
②已知反应III在a点时已达平衡状态,则a点的平衡常数K=。
③b点v(正)v(逆)(填“﹥”,“﹤”,“=”)。
④a点的转化率比c点高的原因可能是。(写出一条即可)
(3)、中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:
①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式。
②根据图示,写出总反应的化学方程式:。
19. 有机碱,例如二甲基胺 、苯胺(
、苯胺( 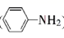 )、二环已基胺(
)、二环已基胺( 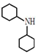 )等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线:
)等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线: 
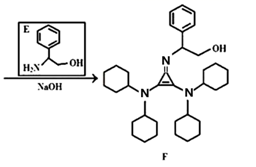
已知如下信息:
①H2C=CH2
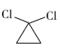
②
 +RNH2
+RNH2 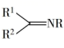
回答下列问题:
(1)、A中所含官能团的名称为 , F的分子式为。(2)、B的结构简式为。(3)、由B生成C的反应类型为。(4)、由C生成D的化学方程式。(5)、E的同分异构体中,能与氢氧化钠反应,且核磁共振氢谱有四组峰,峰面积之比为6:2:2:1的有种,其中,芳香环上为二取代的结构简式为。
-
-