江苏省扬州市2020-2021学年高三下学期化学开学考试试卷
试卷更新日期:2021-03-30 类型:开学考试
一、单选题
-
1. 中国努力争取2060年前实现碳中和。下列说法错误的是( )A、积极鼓励植树造林,降低空气中 含量 B、可利用 或氨水捕集废气中的 C、一定条件下,将 转化为 ,实现 的资源化利用 D、研发新型催化剂将 分解成碳和 ,同时放出热量2. 向 溶液中通入 ,会生成 沉淀,反应为 。下列有关说法正确的是( )A、 的空间构型为正四面体 B、 为非极性分子 C、 的基态核外电子排布式为 D、 的结构示意图为
 3. 下列有关物质的性质与用途具有对应关系的是( )A、 能与碱反应,可用于电解冶炼铝 B、浓硫酸具有吸水性,可用于干燥 C、 受热易分解,可用于制胃酸中和剂 D、 易溶于水,可用作制冷剂4. 是一种重要的化工原料,主要用于生产三氧化硫、亚硫酸盐等,生产 的反应为 。实验室用浓硫酸和 固体反应制取少量 。 排放到大气中会形成酸雨。下列有关 的说法正确的是( )A、 在大气中不能转化为 B、 与 能形成分子间氢键 C、 的水溶液放置在空气中, 增大 D、生产 时 表现出还原性5. 是一种重要的化工原料,主要用于生产三氧化硫、亚硫酸盐等,生产 的反应为 。实验室用浓硫酸和 固体反应制取少量 。 排放到大气中会形成酸雨。下列有关生产 反应的说法正确的是( )A、反应的 B、反应中每消耗 转移的电子的物质的量为 C、升温、加压和使用催化剂能增大 的生成速率 D、当 时,说明该反应处于平衡状态6. 下列实验操作能达到实验目的的是( )
3. 下列有关物质的性质与用途具有对应关系的是( )A、 能与碱反应,可用于电解冶炼铝 B、浓硫酸具有吸水性,可用于干燥 C、 受热易分解,可用于制胃酸中和剂 D、 易溶于水,可用作制冷剂4. 是一种重要的化工原料,主要用于生产三氧化硫、亚硫酸盐等,生产 的反应为 。实验室用浓硫酸和 固体反应制取少量 。 排放到大气中会形成酸雨。下列有关 的说法正确的是( )A、 在大气中不能转化为 B、 与 能形成分子间氢键 C、 的水溶液放置在空气中, 增大 D、生产 时 表现出还原性5. 是一种重要的化工原料,主要用于生产三氧化硫、亚硫酸盐等,生产 的反应为 。实验室用浓硫酸和 固体反应制取少量 。 排放到大气中会形成酸雨。下列有关生产 反应的说法正确的是( )A、反应的 B、反应中每消耗 转移的电子的物质的量为 C、升温、加压和使用催化剂能增大 的生成速率 D、当 时,说明该反应处于平衡状态6. 下列实验操作能达到实验目的的是( ) A、用装置甲电解饱和食盐水获得 B、用装置乙制取并收集少量 C、用 溶液检验 溶液是否变质 D、用饱和 溶液除去 气体中混有的少量7. 、 、 、 是短周期主族元素。下列有关说法正确的是( )A、CO的结构式: B、 中氮原子的轨道杂化类型: C、电负性: D、最高价氧化物的水化物的酸性:8. 具有较强还原性,其溶于水生成的氢硫酸是一种弱酸( 、 )。用 溶液吸收 得 溶液。下列说法正确的是( )A、升高 溶液的温度,一定能提高 的吸收率 B、25℃时,若 溶液中 ,则 C、向 溶液中加入足量浓硝酸,反应生成气体,其主要成分为 D、 [ ]能与 发生反应:9. 已知:①Cu2O的晶胞如下图所示:②Cu2O固体溶于稀硫酸,能得到CuSO4溶液和一种紫红色单质;③向CuSO4溶液中加入一定量NaOH溶液,能得到一种浅蓝绿色沉淀,该沉淀能溶于氨水。下列说法错误的是( )
A、用装置甲电解饱和食盐水获得 B、用装置乙制取并收集少量 C、用 溶液检验 溶液是否变质 D、用饱和 溶液除去 气体中混有的少量7. 、 、 、 是短周期主族元素。下列有关说法正确的是( )A、CO的结构式: B、 中氮原子的轨道杂化类型: C、电负性: D、最高价氧化物的水化物的酸性:8. 具有较强还原性,其溶于水生成的氢硫酸是一种弱酸( 、 )。用 溶液吸收 得 溶液。下列说法正确的是( )A、升高 溶液的温度,一定能提高 的吸收率 B、25℃时,若 溶液中 ,则 C、向 溶液中加入足量浓硝酸,反应生成气体,其主要成分为 D、 [ ]能与 发生反应:9. 已知:①Cu2O的晶胞如下图所示:②Cu2O固体溶于稀硫酸,能得到CuSO4溶液和一种紫红色单质;③向CuSO4溶液中加入一定量NaOH溶液,能得到一种浅蓝绿色沉淀,该沉淀能溶于氨水。下列说法错误的是( ) A、一个Cu2O晶胞中,Cu原子的数目为4 B、②中的反应为 C、③中的浅蓝绿色沉淀为CuOH D、③中沉淀溶解是因为生成了铜氨配合物10. 化合物Y是一种药物中间体,可由X制得。下列有关化合物X、Y的说法正确的是( )
A、一个Cu2O晶胞中,Cu原子的数目为4 B、②中的反应为 C、③中的浅蓝绿色沉淀为CuOH D、③中沉淀溶解是因为生成了铜氨配合物10. 化合物Y是一种药物中间体,可由X制得。下列有关化合物X、Y的说法正确的是( ) A、X分子中的所有碳原子可能处于同一平面 B、Y在浓硫酸作用下加热可发生消去反应 C、X制备Y的反应类型是取代反应 D、X、Y分子中手性碳原子数目相等11. 与 溶液反应会生成 、 、 等物质。室温下,通过下列实验探究这些含磷化合物的性质。
A、X分子中的所有碳原子可能处于同一平面 B、Y在浓硫酸作用下加热可发生消去反应 C、X制备Y的反应类型是取代反应 D、X、Y分子中手性碳原子数目相等11. 与 溶液反应会生成 、 、 等物质。室温下,通过下列实验探究这些含磷化合物的性质。实验
实验操作和现象
1
蘸取 溶液点在 试纸上, ;蘸取 溶液点在 试纸上,
2
向 溶液中加入足量 溶液,生成白色沉淀,蘸取上层清液点在 试纸上,
3
向 中加入足量一定浓度的硫酸,生成 和
4
向含有酚酞的 溶液中滴加 溶液,至溶液由无色变为浅红色
下列有关说法正确的是( )
A、 溶液中存在 B、实验2中发生反应的离子方程式为 C、可用实验3证明 D、实验4的过程中可能存在12. 甲醇—水蒸气重整法所得氢气是电动汽车燃料电池的理想氢源。反应的热化学方程式如下:反应Ⅰ
反应Ⅱ
会损害燃料电池的交换膜。在压强、 和 的起始浓度一定的条件下,催化反应相同时间,测得不同温度下, 的转化率、 的产率和 的物质的量如图中实线所示(图中虚线表示相同条件下达平衡状态时的变化)。已知: 的选择性 。下列说法正确的是( )
 A、 B、210℃升温至270℃时,反应Ⅰ的活化能增大 C、温度升高,反应Ⅰ的速率比反应Ⅱ增加的更多 D、温度升高,n(CO)的实际值与平衡值相差越来越大,原因是催化剂对CO的选择性升高
A、 B、210℃升温至270℃时,反应Ⅰ的活化能增大 C、温度升高,反应Ⅰ的速率比反应Ⅱ增加的更多 D、温度升高,n(CO)的实际值与平衡值相差越来越大,原因是催化剂对CO的选择性升高二、填空题
-
13. 镀镍废水中的Ni2+可用还原铁粉除去。25℃时,部分氢氧化物在废水中开始沉淀和沉淀完全的pH如下表所示:
氢氧化物
Fe(OH)3
Fe(OH)2
Ni(OH)2
开始沉淀的pH
1.5
6.6
7.7
沉淀完全的pH
3.3
9.9
9.2
(1)、还原铁粉的制备:向FeSO4溶液中加入NaBH4 (其中H为-1价)可得还原铁粉,同时生成H3BO3和H2。理论上制备1molFe,需NaBH4的物质的量为mol。(2)、还原铁粉除镍:向废水中加入还原铁粉,可置换出镍。某小组通过实验研究废水中镍的去除效果。①取五份废水样品各100mL,加酸或碱调节其初始pH不等,再加入等量且过量的铁粉,充分反应后测得废水中镍含量随溶液初始pH的变化如图所示。pH太小,残留的镍含量较高,原因是;pH>6.6时,残留的镍含量随溶液初始pH增大而增多的原因是。

②取100mL废水样品,向其中加入适量铁粉,测得溶液的pH、Fe(Ⅱ)的含量和总铁含量变化如图所示,Fe(Ⅱ)表示溶液及沉淀中+2价的铁元素,总铁表示溶液及沉淀中化合态的铁元素。40~60min内,溶液pH约为6.4,该时间段内引起Fe(Ⅱ)含量降低的反应的离子方程式为。

③另取100mL pH约为5.8的废水样品,加入FeCl3溶液,废水中镍含量也有明显降低,原因是。
三、有机推断题
-
14. 汉黄芩素具有抗氧化、抗病毒等多种药理活性,其一种合成路线如下:

已知:BnBr的结构简式为
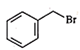 。(1)、A→B时除生成B外,该反应中所得另一有机产物的结构简式为。(2)、D→E的反应有HI生成。PinBH的结构简式为。(3)、F→G的反应中所用DMS易水解生成H4SO4 , 故合成反应须在无水环境中进行。DMS的结构简式为
。(1)、A→B时除生成B外,该反应中所得另一有机产物的结构简式为。(2)、D→E的反应有HI生成。PinBH的结构简式为。(3)、F→G的反应中所用DMS易水解生成H4SO4 , 故合成反应须在无水环境中进行。DMS的结构简式为 ,其水解的化学方程式为。 (4)、A的一种同分异构体同时满足下列条件,该同分异构体的结构简式为。
,其水解的化学方程式为。 (4)、A的一种同分异构体同时满足下列条件,该同分异构体的结构简式为。①苯环上只有一个取代基,能发生银镜反应;
②能发生水解反应,且水解产物之一能与FeCl3溶液发生显色反应;
③分子中有5种不同化学环境的氢。
(5)、写出以 和
和  为原料制备
为原料制备  的合成路线流程图 (无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图 (无机试剂任用,合成路线流程图示例见本题题干)。 四、工业流程题
-
15. 某废催化剂主要成分为活性炭和 ,以该废催化剂为原料回收活性炭并制备超细 的实验流程如下:
 (1)、 的结构为
(1)、 的结构为 ,其中四个 键的键长、键能相同。则该物质中______(填序号)。 A、碳氧键均相同 B、有两种不同的碳氧键 C、有四种不同的碳氧键(2)、预处理时需加热, 分解生成 。若温度高于 ,生成的 会转化为锌蒸气,使 的产率降低。 转化为 的化学方程式为。(3)、浸出时 转化为 ,参加反应的 ,该反应的离子方程式为。(4)、蒸氨时控制温度为 左右,在装置 中 转化为碱式碳酸锌沉淀。实验室模拟蒸氨装置如题图所示。
,其中四个 键的键长、键能相同。则该物质中______(填序号)。 A、碳氧键均相同 B、有两种不同的碳氧键 C、有四种不同的碳氧键(2)、预处理时需加热, 分解生成 。若温度高于 ,生成的 会转化为锌蒸气,使 的产率降低。 转化为 的化学方程式为。(3)、浸出时 转化为 ,参加反应的 ,该反应的离子方程式为。(4)、蒸氨时控制温度为 左右,在装置 中 转化为碱式碳酸锌沉淀。实验室模拟蒸氨装置如题图所示。
①用水蒸气对装置 加热时,连接装置 、 的导管应插入装置 的位置为。(填序号)
A.液面上方但不接触液面
B.略伸入液面下
C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是(写出一种)。
③为提高装置 中氨的吸收效率,在不改变气体流速的条件下,在装置 、 间设计了装置 。其作用为。
(5)、 、 约为6.8时, 溶液与 溶液反应可得碱式碳酸锌。实验室以含少量 的 结块废催化剂为原料制备碱式碳酸锌,设计实验方案: , 过滤,洗涤,干燥。(须使用的试剂:稀 、锌粉、 溶液)(6)、所回收的活性炭的吸附性能可通过测定其碘吸附值( 活性炭能够吸附的碘的质量)分析。测量方法如下:
①将活性炭粉碎并干燥,称取 试样,放入 碘量瓶(如题图所示)中,加入 溶液,加热微沸后冷却至室温,再加入 标准溶液,盖好瓶塞,振荡一段时间,迅速过滤;
②取 滤液放入另一碘量瓶,加入 ,用 标准溶液滴定至终点,消耗 溶液的体积为 。计算该样品的碘吸附值 ( )。(写出计算过程,实验过程中溶液的体积变化忽略不计)已知: (未配平)
五、原理综合题
-
16. 合成氨是目前人工固氮最重要的途径,研究合成氨反应具有重要意义。(1)、直接常压电化学合成氨以纳米 作催化剂, 和 为原料制备 。其工作原理如图所示:

①阴极的电极反应式为;阴极的镍合金制成筛网的目的是。
②电解过程中,由于发生副反应,使得阴极制得的 中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是。
(2)、一定条件下,哈伯-博施合成氨反应历程中的能量变化如图所示。合成氨反应的热化学方程式为。生成 的历程中,速率最慢的反应的化学方程式为。 (3)、科学家一直努力寻找提高合成氨效率的催化剂,一种新型高催化活性的催化剂 的催化活性与其中 的关系如图所示, (用分数表示)。
(3)、科学家一直努力寻找提高合成氨效率的催化剂,一种新型高催化活性的催化剂 的催化活性与其中 的关系如图所示, (用分数表示)。 (4)、 在铁表面很容易解离成 原子,而 在铁表面较难解离。为研究哈伯-博施合成氨反应中与 直接反应的是 还是 ,德国化学家格哈德·埃特尔设计如下实验:将铁催化剂置于真空容器中,通入一定量的 ,再向其中不断通入 ,同时测得催化剂表面某原子的浓度不断减小。根据实验结果他提出了反应的机理,如图所示。
(4)、 在铁表面很容易解离成 原子,而 在铁表面较难解离。为研究哈伯-博施合成氨反应中与 直接反应的是 还是 ,德国化学家格哈德·埃特尔设计如下实验:将铁催化剂置于真空容器中,通入一定量的 ,再向其中不断通入 ,同时测得催化剂表面某原子的浓度不断减小。根据实验结果他提出了反应的机理,如图所示。
①该实验中测定的是催化剂表面原子浓度的变化。
②图中 的电子式为。
-
-
-