山东省名校联盟2020-2021学年高三下学期化学开学考试试卷(新高考)
试卷更新日期:2021-03-30 类型:开学考试
一、单选题
-
1. 化学与生活密切相关。下列叙述错误的是( )A、碳酸钠可用于制造普通玻璃 B、高纯硅可用于制作光感电池 C、碳酸钡可用于X射线造影检查 D、漂白粉可用作泳池等场所的消毒剂2. Mg(NH)2可发生水解:Mg(NH)2+2H2O=N2H4+Mg(OH)2。下列表示相关微粒的化学用语正确的是( )A、中子数为8的氧原子: O B、N2H4的结构式:
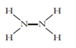 C、Mg2+的结构示意图:
C、Mg2+的结构示意图: 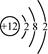 D、H2O的电子式:
D、H2O的电子式: 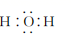 3. 《汉书·货殖列传》中记载:“章山之铜,所谓丹阳铜也。今世有白铜,盖点化为之,非其本质。”已知白铜中含有锡元素,下列说法错误的是( )A、纯铜比白铜硬度小,熔点高 B、纯铜和白铜都可耐强酸、强碱腐蚀 C、白铜置于潮湿的空气中,Cu受到保护 D、铜和锡都可用于制作生活中的器皿4. 下列关于有机化合物的说法正确的是( )A、
3. 《汉书·货殖列传》中记载:“章山之铜,所谓丹阳铜也。今世有白铜,盖点化为之,非其本质。”已知白铜中含有锡元素,下列说法错误的是( )A、纯铜比白铜硬度小,熔点高 B、纯铜和白铜都可耐强酸、强碱腐蚀 C、白铜置于潮湿的空气中,Cu受到保护 D、铜和锡都可用于制作生活中的器皿4. 下列关于有机化合物的说法正确的是( )A、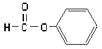 属于醛类,官能团为-CHO
B、分子式为C5H10O2的有机物中能与NaOH溶液反应的有4种
C、立方烷(
属于醛类,官能团为-CHO
B、分子式为C5H10O2的有机物中能与NaOH溶液反应的有4种
C、立方烷(  )的六氨基(-NH2)取代物有3种
D、烷烃
)的六氨基(-NH2)取代物有3种
D、烷烃  的符合题意命名是2-甲基-3-丙基戊烷
5. 下列有关说法错误的是( )A、 与 互为同位素 B、乙二醇和甘油不互为同系物 C、蛋白质溶液和NaCl溶液可根据丁达尔效应进行区分 D、卤水点豆腐、微波手术刀开刀处血液迅速凝固都是胶体的聚沉现象6. 图中所示的实验方案,能达到实验目的的是( )
的符合题意命名是2-甲基-3-丙基戊烷
5. 下列有关说法错误的是( )A、 与 互为同位素 B、乙二醇和甘油不互为同系物 C、蛋白质溶液和NaCl溶液可根据丁达尔效应进行区分 D、卤水点豆腐、微波手术刀开刀处血液迅速凝固都是胶体的聚沉现象6. 图中所示的实验方案,能达到实验目的的是( )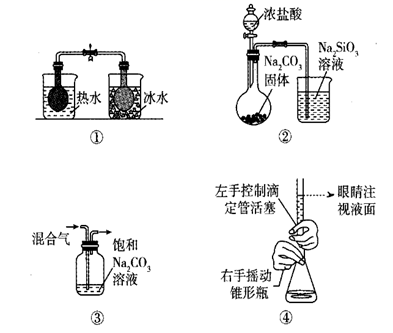 A、①探究温度对平衡2NO2(g) N2O4(g)的影响 B、②探究C和Si非金属性的强弱 C、③除去CO2气体中混有的HCl D、④用高锰酸钾标准液滴定市场上的双氧水溶液7. 氮循环是海洋生态系统的基础。海洋中无机氮循环的过程如图所示。下列叙述错误的是( )
A、①探究温度对平衡2NO2(g) N2O4(g)的影响 B、②探究C和Si非金属性的强弱 C、③除去CO2气体中混有的HCl D、④用高锰酸钾标准液滴定市场上的双氧水溶液7. 氮循环是海洋生态系统的基础。海洋中无机氮循环的过程如图所示。下列叙述错误的是( )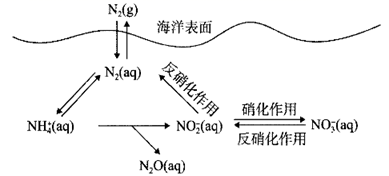 A、“硝化作用”可能有氧气的参与 B、氮循环中涉及氮的固定 C、向海水中大量排放含有 的废水会打破氮循环的稳态 D、 是歧化反应8. 下列实验现象与实验操作不匹配的是( )
A、“硝化作用”可能有氧气的参与 B、氮循环中涉及氮的固定 C、向海水中大量排放含有 的废水会打破氮循环的稳态 D、 是歧化反应8. 下列实验现象与实验操作不匹配的是( )选项
实验操作
实验现象
A
向蔗糖中加入浓硫酸,并将产生的气体通过足量溴水
蔗糖变黑,膨胀,溴水褪色,有气泡冒出
B
将少量硼酸滴入 溶液中
有气泡产生
C
向盛有 溶液的试管中滴加浓的维生素C溶液
溶液由黄色变为浅绿色
D
Mg和盐酸反应,将温度计水银球插入反应液中
镁条逐渐溶解,产生气泡,温度计水银柱迅速上升
A、A B、B C、C D、D9. 下列关于物质结构与性质的说法,错误的是( )A、I3AsF6晶体中存在I3+离子,I3+离子的几何构型为V形 B、C,H,O三种元素的电负性由小到大的顺序为H<C<O C、水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S D、第四周期元素中,Ga的第一电离能低于Zn10. 短周期主族元素X、Y、Z、W的原子序数依次增大,化合物X2W与化合物与WY2相遇会产生淡黄色固体,四种元素的最外层电子数满足X+Y=Z+W。下列叙述错误的是( )A、第一电离能:Y>W>Z B、简单离子半径:W>Y>Z>X C、Y与W具有相同的最高正化合价 D、Z与W形成的化合物水溶液呈碱性11. 下列反应的离子方程式正确的是( )A、氯化铝溶液中滴加足量氨水:Al3++3NH3•H2O Al(OH)3↓+3NH B、碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO +OH-=CO +H2O C、向氢氧化钡溶液中加入稀硫酸:Ba2++SO =BaSO4↓ D、向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-12. 科学家提出利用离子交换膜组合工艺将电解制备金属锰和二氧化锰工艺联用,实现同步制备金属锰和二氧化锰并实现回收硫酸的目的,工艺原理如图,下列有关说法中错误的是( )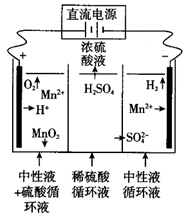 A、阴极的电极反应式为计Mn2++2H2O-2e-=MHO2 +4H+ B、左侧为阳离子交换膜 C、右侧电解液含有MnSO4和(NH4)2SO4 , 可以防止产生Mn(OH)2并提高溶液导电性 D、实际生产中不能用氯化锰溶液代替硫酸锰溶液13. 25℃时,向20mL0.1000mol•L-1HA溶液中滴入0.1000mol•L-1NaOH溶液。下列说法正确的是( )A、若0.1000mol•L-1HA溶液的pH=3,则此温度下Ka(HA)的数量级为10-6 B、滴入10mL0.1000mol•L-1NaOH溶液,则可能存在:2c(H+)+c(A-)=2c(OH-)+c(HA) C、若pH>7,则溶液中可能存在:c(Na+)>c(OH-)>c(A-)>c(H+) D、若溶质为NaA,则溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+)
A、阴极的电极反应式为计Mn2++2H2O-2e-=MHO2 +4H+ B、左侧为阳离子交换膜 C、右侧电解液含有MnSO4和(NH4)2SO4 , 可以防止产生Mn(OH)2并提高溶液导电性 D、实际生产中不能用氯化锰溶液代替硫酸锰溶液13. 25℃时,向20mL0.1000mol•L-1HA溶液中滴入0.1000mol•L-1NaOH溶液。下列说法正确的是( )A、若0.1000mol•L-1HA溶液的pH=3,则此温度下Ka(HA)的数量级为10-6 B、滴入10mL0.1000mol•L-1NaOH溶液,则可能存在:2c(H+)+c(A-)=2c(OH-)+c(HA) C、若pH>7,则溶液中可能存在:c(Na+)>c(OH-)>c(A-)>c(H+) D、若溶质为NaA,则溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+)二、多选题
-
14. 茴香醛可用于香料的配制和有机合成,其中间茴香醛的结构简式如图所示。下列关于茴香醛的说法正确的是( )
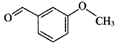 A、其分子式是C8H8O2 B、分子中π键与σ键数目之比为2:9 C、分子中所有碳原子可能共平面 D、对茴香醛中含有3种不同化学环境的氢原子15. 焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染等方面应用广泛。利用SO2生产Na2S2O5的工艺如图:
A、其分子式是C8H8O2 B、分子中π键与σ键数目之比为2:9 C、分子中所有碳原子可能共平面 D、对茴香醛中含有3种不同化学环境的氢原子15. 焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染等方面应用广泛。利用SO2生产Na2S2O5的工艺如图: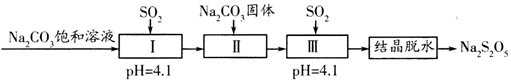
资料:Na2S2O5通常是由NaHSO3过饱和溶液经结晶脱水制得,下列说法正确的是( )
A、Na2S2O5是Na2SO3和SO2的混合物 B、pH=4.1时,I中主要反应的化学方程式为Na2CO3+SO2=Na2SO3+CO2 C、加入Na2CO3固体的目的是调节pH,促进Ⅲ中SO2的再吸收 D、“结晶脱水”过程中反应的化学方程式为2NaHSO3=Na2S2O5+H2O三、综合题
-
16. 葡萄糖酸亚铁(C6H11O7)2Fe是常用的补铁剂,易溶于水。用如图装置制备FeCO3 , 提取出的FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。请回答下列问题:
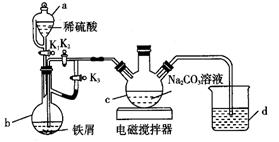 (1)、装置c的名称为。(2)、打开K1、K3 , 关闭K2 , 开始反应。一段时间后关闭K3 , 打开K2。在装置c中制得碳酸亚铁。实验过程中产生的H2作用有。(3)、将制得的碳酸亚铁浊液过滤、洗涤。如过滤时间过长会发现产品部分变为红褐色,用化学方程式说明其原因:。(4)、将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。加入乙醇的目的是。(5)、用NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,该反应的离子方程式为 , 此法产品纯度更高,原因是。17. 氨氮(NH3、NH4+等)是一种重要污染物,可利用合适的氧化剂氧化去除。(1)、氯气与水反应产生的HClO可去除废水中含有的NH3。
(1)、装置c的名称为。(2)、打开K1、K3 , 关闭K2 , 开始反应。一段时间后关闭K3 , 打开K2。在装置c中制得碳酸亚铁。实验过程中产生的H2作用有。(3)、将制得的碳酸亚铁浊液过滤、洗涤。如过滤时间过长会发现产品部分变为红褐色,用化学方程式说明其原因:。(4)、将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。加入乙醇的目的是。(5)、用NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,该反应的离子方程式为 , 此法产品纯度更高,原因是。17. 氨氮(NH3、NH4+等)是一种重要污染物,可利用合适的氧化剂氧化去除。(1)、氯气与水反应产生的HClO可去除废水中含有的NH3。已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=kJ·mol-1。
(2)、在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。
①写出电解时阳极的电极反应式:。
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是。
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是。
(3)、高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为。
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是。
 18. 镉(Cd)可用于制作某些发光电子组件。一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如下:
18. 镉(Cd)可用于制作某些发光电子组件。一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如下: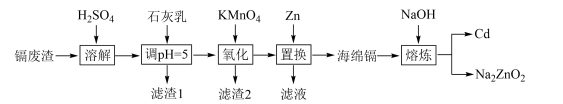
回答下列问题:
(1)、“滤渣1”的主要成分为 Cu(OH)2和(填化学式)。(2)、“氧化”时KMnO4的还原产物是MnO2 , 该步骤中除铁、除锰的离子方程式分别为、。(3)、“置换”中镉置换率与( )的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。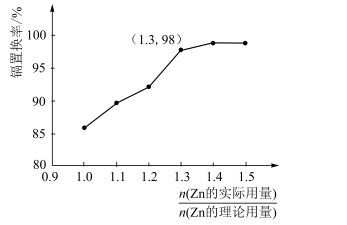
①实际生产中 比值最佳为1.3,不宜超过该比值的原因是。
②若需置换出112kgCd,且使镉置换率达到98%,实际加入的Zn应为kg。
(4)、“置换”后滤液溶质主要成分是(填化学式)。(5)、“熔炼”时,将海绵镉(含Cd和Zn)与NaOH混合反应,反应的化学方程式是。当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的不同,将Cd从反应釜下口放出,以达到分离的目的。19. 硫、钒化合物在药物化学及催化化学等领域应用广泛。回答下列问题:(1)、基态钒原子的价层电子排布图为 , 钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是 , 的空间构型为。(2)、2-巯基烟酸氧钒配合物(图甲)是副作用小的有效调节血糖的新型药物: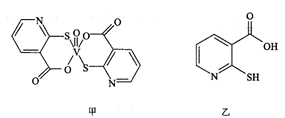
该药物中N原子的杂化方式是;2-巯基烟酸(图乙)水溶性优于2-巯基烟酸氧钒配合物(图甲)的原因是。
(3)、某六方硫钒化合物晶体的晶胞如图丙所示,该晶胞的化学式为。图丁为该晶胞的俯视图,该晶胞的密度为 (列出计算式即可)。 20. 琥珀酸二乙酯可用作增塑剂、特种润滑剂和有机合成中间体。以乙烯为原料制备琥珀酸二乙酯的合成路线如图:
20. 琥珀酸二乙酯可用作增塑剂、特种润滑剂和有机合成中间体。以乙烯为原料制备琥珀酸二乙酯的合成路线如图: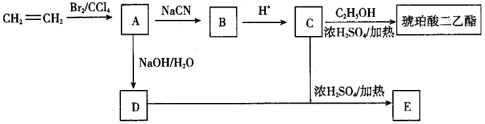
已知:①RBr+NaCN→RCN+NaBr;
②RCN+2H2O+H+→RCOOH+NH 。
完成下列填空:
(1)、乙烯生成A的反应类型为 , A的名称是。(2)、B的结构简式为 , 琥珀酸二乙酯的结构简式为。(3)、A→D的化学方程式为。(4)、E为八元环状化合物,E中含有的官能团名称为;C和D在一定的条件下还可生成高分子化合物,之所以能生成高分子化合物是因为。(5)、已知氧化羟基的条件足以氧化有机分子中的碳碳双键,试设计由丙烯醇(CH2=CHCH2OH)制丙烯酸(CH2=CHCOOH)的合成路线:。(合成路线常用的表示方式为甲 乙…… 目标产物)