辽宁省名校联盟2020-2021学年高三下学期化学开学考试试卷(新高考)
试卷更新日期:2021-03-30 类型:开学考试
一、单选题
-
1. 化学与生活密切相关,下列说法正确的是( )A、芯片制造中的“光刻技术”是利用光敏树脂曝光成像,该过程涉及化学变化 B、推广使用煤液化技术,可减少二氧化碳等温室气体的排放 C、汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 D、古人煮沸海水制取淡水,现代可向海水中加明矾实现淡化2. 已知反应 ,其中用化学用语描述的相关微粒正确的是( )A、中子数为18的氯原子 B、 属于离子化合物,不含共价键 C、 的结构式:
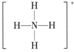 D、 的电子式:
D、 的电子式: 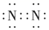 3. X、Y、Z、W均为短周期主族元素,且原子序数依次递增。基态X原子核外有电子的能级是3个,且3个能级上的电子数相等,W与X同主族,Y的氢化物与其最高价氧化物对应的水化物可形成一种盐,Z为所在周期中原子半径最大的元素。下列说法正确的是( )A、电负性:Z>W>X>Y B、简单氢化物的稳定性:W>Y>X C、X的含氧酸与Y的氢化物形成的化合物中都只含离子键 D、Z与W形成的含氧酸盐的溶液显碱性4. 我国对铜的认识年代久远,下列关于铜的几种表述正确的是( )A、基态Cu原子的电子排布式:[As]4s1 B、基态Cu原子的最高能层符号为N C、基态Cu原子的价电子排布图为
3. X、Y、Z、W均为短周期主族元素,且原子序数依次递增。基态X原子核外有电子的能级是3个,且3个能级上的电子数相等,W与X同主族,Y的氢化物与其最高价氧化物对应的水化物可形成一种盐,Z为所在周期中原子半径最大的元素。下列说法正确的是( )A、电负性:Z>W>X>Y B、简单氢化物的稳定性:W>Y>X C、X的含氧酸与Y的氢化物形成的化合物中都只含离子键 D、Z与W形成的含氧酸盐的溶液显碱性4. 我国对铜的认识年代久远,下列关于铜的几种表述正确的是( )A、基态Cu原子的电子排布式:[As]4s1 B、基态Cu原子的最高能层符号为N C、基态Cu原子的价电子排布图为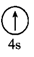 D、基态Cu2+的未成对电子数为2
5. 利用下列装置(夹持装置略)进行实验,不能达到实验目的的是( )
D、基态Cu2+的未成对电子数为2
5. 利用下列装置(夹持装置略)进行实验,不能达到实验目的的是( )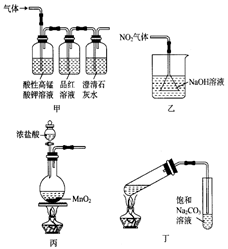 A、用甲装置检验 中是否混有 B、用乙装置防止倒吸 C、用丙装置制取 D、用丁装置制备并收集乙酸乙酯6. 维生素B5可以减轻抗生素等药物引起的毒副作用,其结构为
A、用甲装置检验 中是否混有 B、用乙装置防止倒吸 C、用丙装置制取 D、用丁装置制备并收集乙酸乙酯6. 维生素B5可以减轻抗生素等药物引起的毒副作用,其结构为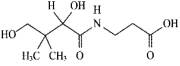 。下列关于维生素B5的说法正确的是( ) A、该物质可发生消去反应生成碳碳双键 B、分子中含有8个碳原子 C、一定条件下,1mol维生素B5最多可与1molNaOH发生反应 D、该物质以及所有的水解产物均能发生聚合反应7. 下列各组实验中,对应的现象和结论都正确,且两者具有因果关系的是( )
。下列关于维生素B5的说法正确的是( ) A、该物质可发生消去反应生成碳碳双键 B、分子中含有8个碳原子 C、一定条件下,1mol维生素B5最多可与1molNaOH发生反应 D、该物质以及所有的水解产物均能发生聚合反应7. 下列各组实验中,对应的现象和结论都正确,且两者具有因果关系的是( )实验操作
现象
结论
A
向等物质的量浓度的 混合溶液中滴加NaOH溶液
开始时得到红褐色沉淀
相同温度下 :
B
向 溶液中滴加少量氯水
溶液变黄色
还原性:
C
向2 mL等物质的量浓度的 溶液中分别滴加2滴酚酞试液
溶液颜色较深
酸性:
D
向2 mL 5%、2 mL 10%的双氧水中分别加入等物质的量的X、Y两种催化剂
加入Y催化剂的双氧水中产生气泡速率快
催化效果:Y>X
A、A B、B C、C D、D8. 我国科研工作者研制出基于 (聚丙烯酸钠)电解质的 空气可充电电池,该电池具有高容量和超长循环稳定性。 是一种超强吸水聚合物,可吸收大量 和 溶液作为水和离子含量调节剂形成水凝胶电解质,示意图如图。已知: 。下列说法错误的是( )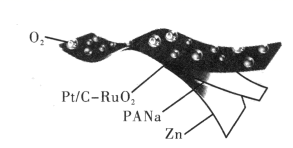 A、 是一种有机高分子聚合物,在水溶液中不会发生电离 B、放电时,负极反应式为 C、充电时,阴极附近pH增大,阳极附近pH减小 D、充电时,电路中通过0.4mol电子时,有2.24L(标准状况下) 生成9. 科学家提出由WO3催化乙烯和2-丁烯合成丙烯的反应历程如图(所有碳原子最外层均满足8电子结构)。下列说法错误的是( )
A、 是一种有机高分子聚合物,在水溶液中不会发生电离 B、放电时,负极反应式为 C、充电时,阴极附近pH增大,阳极附近pH减小 D、充电时,电路中通过0.4mol电子时,有2.24L(标准状况下) 生成9. 科学家提出由WO3催化乙烯和2-丁烯合成丙烯的反应历程如图(所有碳原子最外层均满足8电子结构)。下列说法错误的是( )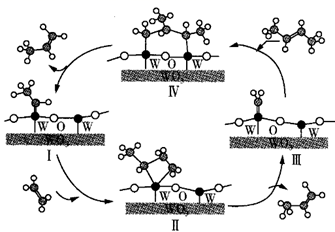 A、乙烯、2-丁烯和丙烯互为同系物 B、丙烯在一定条件下发生加聚反应的产物为
A、乙烯、2-丁烯和丙烯互为同系物 B、丙烯在一定条件下发生加聚反应的产物为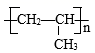 C、合成丙烯总反应的原子利用率为100%
D、碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ过程中未发生断裂
10. 向一绝热的刚性容器中加入反应物 和 ,仅发生反应: ,已知逆反应速率随时间的变化如图所示。下列分析错误的是( )
C、合成丙烯总反应的原子利用率为100%
D、碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ过程中未发生断裂
10. 向一绝热的刚性容器中加入反应物 和 ,仅发生反应: ,已知逆反应速率随时间的变化如图所示。下列分析错误的是( )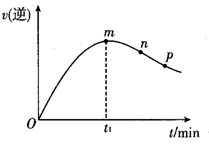 A、 B、 时, > C、该反应平衡常数K随着温度的升高而增大 D、n点反应物的转化率高于p点11. 室温下,取20 mL 0.1 mol·L−1某二元酸H2A,滴加0.2 mol·L−1 NaOH溶液。已知:H2A=H++HA− , HA−⇌H++A2−。下列说法错误的是( )A、0.1 mol·L−1 H2A溶液中有c(H+)-c(OH−)-c(A2−)=0.1 mol·L−1 B、当滴加至中性时,溶液中c(Na+)=c(HA−)+2c(A2−),用去NaOH溶液的体积小于10 mL C、当用去NaOH溶液体积10 mL时,溶液的pH<7,此时溶液中有c(A2−)=c(H+)-c(OH−) D、当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=2c(HA−)+2c(A2−)12. 下列有关金刚石晶体和二氧化硅晶体(如图所示)的叙述正确的是( )
A、 B、 时, > C、该反应平衡常数K随着温度的升高而增大 D、n点反应物的转化率高于p点11. 室温下,取20 mL 0.1 mol·L−1某二元酸H2A,滴加0.2 mol·L−1 NaOH溶液。已知:H2A=H++HA− , HA−⇌H++A2−。下列说法错误的是( )A、0.1 mol·L−1 H2A溶液中有c(H+)-c(OH−)-c(A2−)=0.1 mol·L−1 B、当滴加至中性时,溶液中c(Na+)=c(HA−)+2c(A2−),用去NaOH溶液的体积小于10 mL C、当用去NaOH溶液体积10 mL时,溶液的pH<7,此时溶液中有c(A2−)=c(H+)-c(OH−) D、当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=2c(HA−)+2c(A2−)12. 下列有关金刚石晶体和二氧化硅晶体(如图所示)的叙述正确的是( )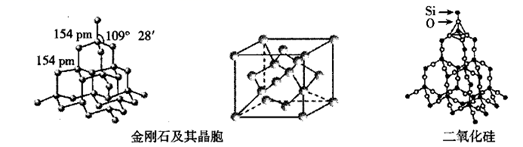 A、金刚石晶体和二氧化硅晶体均属于原子晶体 B、金刚石晶胞中含有6个碳原子 C、 晶体中所含共价键数目为 ( 是阿伏加德罗常数的值) D、金刚石晶体熔化时破坏共价键,二氧化硅晶体熔化时破坏分子间作用力13. 我国科学家实现了在铜催化条件下将DMF[(CH3)3NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是( )
A、金刚石晶体和二氧化硅晶体均属于原子晶体 B、金刚石晶胞中含有6个碳原子 C、 晶体中所含共价键数目为 ( 是阿伏加德罗常数的值) D、金刚石晶体熔化时破坏共价键,二氧化硅晶体熔化时破坏分子间作用力13. 我国科学家实现了在铜催化条件下将DMF[(CH3)3NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是( )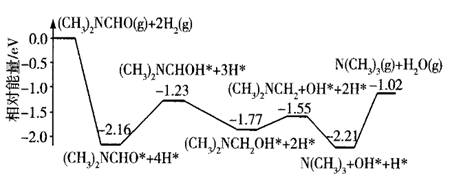 A、由图可以判断DMF转化为三甲胺的反应属于吸热反应 B、 是该反应历程的决速步 C、使用铜作催化剂可以降低反应的活化能,从而改变反应的焓变 D、该历程中最大能垒(活化能)E正=2.16 eV14. 磷酸铝 是一种用途广泛的材料,由磷硅渣[主要成分为 、 、 等]制备磷酸铝的工艺流程如下:
A、由图可以判断DMF转化为三甲胺的反应属于吸热反应 B、 是该反应历程的决速步 C、使用铜作催化剂可以降低反应的活化能,从而改变反应的焓变 D、该历程中最大能垒(活化能)E正=2.16 eV14. 磷酸铝 是一种用途广泛的材料,由磷硅渣[主要成分为 、 、 等]制备磷酸铝的工艺流程如下: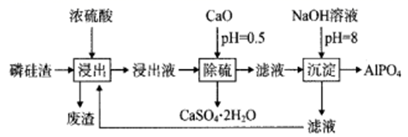
下列叙述错误的是( )
A、废渣中一定含 B、“浸出”和“除硫”的操作均在高温下进行 C、“除硫”的化学反应方程式为 D、流程中的循环操作可以提高P、Al元素的利用率15. 某硫酸盐在水中的沉淀溶解平衡曲线如下(M2+代表+2价金属离子)。下列说法正确的是( )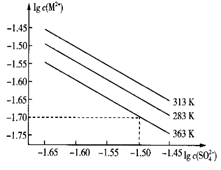 A、363 K时,该硫酸盐的溶度积Ksp的数量级为10-3 B、温度一定时溶度积Ksp随c( )的增大而减小 C、313 K下的该盐饱和溶液升温到363 K时有固体析出 D、283 K下的该盐饱和溶液升温到313 K时有固体析出
A、363 K时,该硫酸盐的溶度积Ksp的数量级为10-3 B、温度一定时溶度积Ksp随c( )的增大而减小 C、313 K下的该盐饱和溶液升温到363 K时有固体析出 D、283 K下的该盐饱和溶液升温到313 K时有固体析出二、综合题
-
16. 高铁酸钾为紫色固体,极易溶于水,微溶于浓KOH溶液,难溶于有机溶剂;在酸性、中性溶液中易分解放出 ,在0~5℃、强碱性溶液中较稳定。某兴趣小组利用如图所示装置(夹持、加热等装置略)制取 并探究其性质。回答下列问题:(1)、Ⅰ.制取

仪器a的名称是 , 装置D的作用是(用离子方程式表示)。
(2)、装置A中反应的离子方程式为。(3)、装置C中反应为放热反应,控制反应温度在0-5℃的方法是。(4)、Ⅱ.探究 性质。取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。生成的可能原因:① 氧化 ;②(用离子方程式表示)。为探究 产生的原因,设计以下方案:
方案甲
取少量溶液a,滴加KSCN溶液至过量,溶液量红色
方案乙
用KOH浓溶液充分洗涤C中所得晶体,再用KOH稀溶液将 溶解,得紫色溶液b。取少量溶液b,滴加盐酸,有 产生
由方案甲中溶液变红知溶液a中含有(填离子符号),但该离子不一定是 将 氧化所得,还可能由产生(用离子方程式表示)。方案乙可证明酸性条件下 氧化 产生 。
17. 掺杂硒的纳米氧化亚铜催化剂可用于工业上合成甲醇,其反应为 。已知: , ,其中k正、k逆为速率常数,c为各组分的物质的量浓度。回答下列问题:(1)、若按 的投料比将 与CO充入VL的刚性恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
①压强p1、P2、P3由小到大的顺序是。
②T1℃,若向该容器中充入3.0 mol 和3.0 mol CO发生上述反应,5 min后反应达到平衡(M点),则0~5 min内, ,则N点的 。
③X、Y、M、N四点,平衡常数从大到小关系是。
(2)、若向起始温度为325℃的10 L刚性恒容密闭容器中充入2 mol CO和3 mol ,发生反应,体系总压强 与时间 的关系如图中曲线Ⅰ所示;曲线Ⅱ为只改变某一条件的变化曲线,曲线中平衡温度与起始温度相同。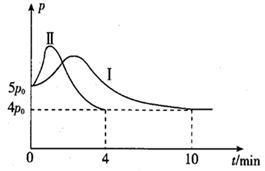
①曲线Ⅱ所对应的改变的条件可能为。
②体系总压强先增大后减小的原因为。
③该条件下 的平衡转化率为%(结果保留一位小数)。
18. 锂辉矿是生产锂离子电池的重要矿物资源。锂辉矿的主要成分为 ,主要杂质为 。盐焙烧工艺提取锂辉矿中锂的工艺流程如图所示: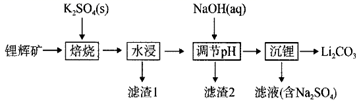
已知:① 的 , 的 ,溶液中离子浓度小于 时,即认为沉淀完全。
②碳酸锂在不同温度下的溶解度如表所示:
温度/℃
0
10
20
50
75
100
的溶解度/g
1.539
1.406
1.329
1.181
0.866
0.728
回答下列问题:
(1)、已知滤渣1的主要成分是 ,“焙烧”过程发生反应的化学方程式为。(2)、“水浸”过程中,为提高浸出速率,可采取的措施有(写出两条);加入NaOH溶液的目的是去除 ,“调节pH”过程需要调节pH的范围是。(3)、“沉锂”过程发生反应的化学方程式为。(4)、洗涤产品 需要使用(填“冷水”或热水”),理由是 , 检验已洗涤干净的方法是。(5)、某工厂用at锂辉矿(含 93%)制得bt ,则 的产率为。19. 化合物G是药物合成中一种重要的中间体,其合成路线如下: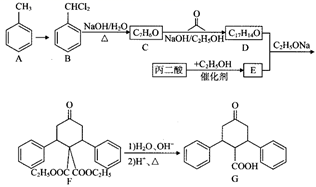
已知:①
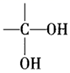 →
→ 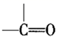 +H2O;
+H2O;②R1CHO+R2CH2CHO
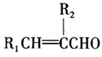 +H2O( 、 为烃基或H);
+H2O( 、 为烃基或H);③
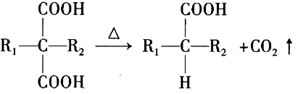 ( 和 代表烷基)。
( 和 代表烷基)。回答下列问题:
(1)、写出A到B的试剂与反应条件为 , C的名称为。(2)、D的结构简式为。(3)、丙二酸生成E的反应类型为。(4)、B生成C的化学方程式是。(5)、B的芳香族化合物的同分异构体共有种(不考虑立体异构),其中核磁共振氢谱有3组峰的同分异构体的结构简式为(任写一种)。(6)、设计以CH2=CH-CH3为原料合成 的合成路线:(无机试剂任选)。
的合成路线:(无机试剂任选)。