湖南省名校联盟2020-2021学年高三下学期化学开学考试试卷(新高考)
试卷更新日期:2021-03-30 类型:开学考试
一、单选题
-
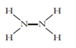
1. 下列诗句或谚语都与化学现象有关,下列说法错误的是( )A、"忽闻海上有仙山,山在虚无缥缈间"的海市蜃楼是一种自然现象,与胶体知识有关 B、"落汤螃蟹着红袍"肯定发生了化学变化 C、"滴水石穿"包含化学变化,而"绳锯木断"则不包含化学变化 D、“熬胆矾铁釜,久之亦化为铜”是发生了复分解反应2. Mg(NH)2可发生水解:Mg(NH)2+2H2O=N2H4+Mg(OH)2。下列表示相关微粒的化学用语正确的是( )A、中子数为8的氧原子: O B、N2H4的结构式:
 C、Mg2+的结构示意图:
C、Mg2+的结构示意图: 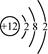 D、H2O的电子式:
D、H2O的电子式: 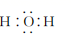 3. 关于化合物2−苯基丙烯(
3. 关于化合物2−苯基丙烯(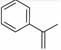 ),下列说法正确的是( ) A、不能使稀高锰酸钾溶液褪色 B、可以发生加成聚合反应 C、分子中所有原子共平面 D、易溶于水及甲苯4. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、2.8g14N2与14C16O的混合物中,中子数目为 1.4NA B、含 0. 1 molFeCl3的溶液与0. 1mol 锌充分反应,转移电子数为0.1NA C、标准状况下,5.6gC4H8中 C-C 的数目可能为0.4NA D、某温度下,1LpH=9 的 Na2CO3 溶液中,水电离产生的OH-数目为10-5 NA5. 下列实验操作或装置能达到目的的是( )
),下列说法正确的是( ) A、不能使稀高锰酸钾溶液褪色 B、可以发生加成聚合反应 C、分子中所有原子共平面 D、易溶于水及甲苯4. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、2.8g14N2与14C16O的混合物中,中子数目为 1.4NA B、含 0. 1 molFeCl3的溶液与0. 1mol 锌充分反应,转移电子数为0.1NA C、标准状况下,5.6gC4H8中 C-C 的数目可能为0.4NA D、某温度下,1LpH=9 的 Na2CO3 溶液中,水电离产生的OH-数目为10-5 NA5. 下列实验操作或装置能达到目的的是( )A
B
C
D
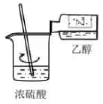
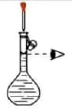
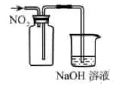
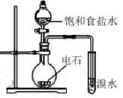
混合浓硫酸和乙醇
配制一定浓度的溶液
收集 气体
证明乙炔可使溴水褪色
A、A B、B C、C D、D6. 短周期元素W、X、Y、Z原子序数依次增大,甲、乙、丙、丁、戊、己是由这些元素构成的物质。常温下,丙和戊是单质气体,乙为生活中常见的无色液体,戊能使带火星的木条复燃,0.01mol/L丁溶液pH=12,上述物质的转化关系如图所示.下面说法正确的是( )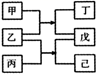 A、原子半径:X<Y<Z B、单质沸点:W>X C、气态氢化物的热稳定性:X>Y D、Y和Z形成的化合物溶于水显碱性7. 研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法错误的是( )
A、原子半径:X<Y<Z B、单质沸点:W>X C、气态氢化物的热稳定性:X>Y D、Y和Z形成的化合物溶于水显碱性7. 研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法错误的是( )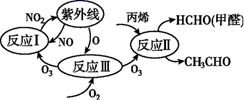 A、反应Ⅰ、反应Ⅱ均属于氧化还原反应 B、整个过程中O3作催化剂 C、光化学烟雾中含甲醛、乙醛等刺激性物质 D、反应Ⅲ的方程式为O2+ O = O38. 过氧化钠可用作熔矿剂,使一些难溶于酸的矿物变成可溶于水或酸的物质。过氧化钠与铬铁矿[主要成分为亚铬酸亚铁 ]反应的化学方程式为 ,下列有关说法错误的是( )A、 分别和 反应,生成物均为 B、该反应中的氧化产物是 C、若有2 mol 被氧化,则被 还原的 为1 mol D、每生成18.6 g氧化钠转移电子的物质的量是1.4 mol9. 是一种储氢材料,可作为固体火箭推进剂中的金属燃烧剂。通过激光加热引发 的燃烧反应,燃烧过程中其表面温度随时间的变化关系如图所示。燃烧不同阶段发生的主要变化如下:
A、反应Ⅰ、反应Ⅱ均属于氧化还原反应 B、整个过程中O3作催化剂 C、光化学烟雾中含甲醛、乙醛等刺激性物质 D、反应Ⅲ的方程式为O2+ O = O38. 过氧化钠可用作熔矿剂,使一些难溶于酸的矿物变成可溶于水或酸的物质。过氧化钠与铬铁矿[主要成分为亚铬酸亚铁 ]反应的化学方程式为 ,下列有关说法错误的是( )A、 分别和 反应,生成物均为 B、该反应中的氧化产物是 C、若有2 mol 被氧化,则被 还原的 为1 mol D、每生成18.6 g氧化钠转移电子的物质的量是1.4 mol9. 是一种储氢材料,可作为固体火箭推进剂中的金属燃烧剂。通过激光加热引发 的燃烧反应,燃烧过程中其表面温度随时间的变化关系如图所示。燃烧不同阶段发生的主要变化如下: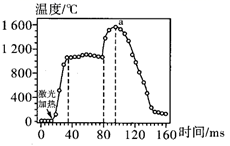
下列说法正确的是( )
A、 燃烧需要激光加热引发,所以 燃烧是吸热反应 B、 的燃烧热 C、加入某种催化剂,反应的 会发生变化 D、在反应过程中,a点物质具有的总能量最大10. 下列指定反应的离子方程式正确的是( )A、金属钠与水反应:2Na + 2H2O =2Na+ + 2OH- + H2↑ B、电解熔融NaCl:2Cl- + 2H2O 2OH- + Cl2↑ + H2↑ C、用氨水溶解AgCl沉淀:Ag++2NH3·H2O=[Ag(NH3)2]+ +2H2O D、Na2CO3溶液吸收溴蒸气:3CO + Br2=Br-+BrO +3CO211. 我国科学家研发了一种室温下“可呼吸”的 二次电池.将 溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为: 。下列说法错误的是( )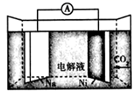 A、放电时, 向负极移动 B、放电时, 向正极移动 C、放电时,正极反应为: D、放电时,正极反应为:12. 根据下列实验操作和现象所得到的结论正确的是( )
A、放电时, 向负极移动 B、放电时, 向正极移动 C、放电时,正极反应为: D、放电时,正极反应为:12. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
实验结论
A
向苯中加入少量溴水、振荡,水层变成无色
苯与溴水发生取代反应
B
向久置的Na2SO3溶液中加入足量BaCl2溶液,
出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解
部分Na2SO3被氧化
C
向溶液中加入少量盐酸生成白色沉淀
溶液中一定含有
D
SO2通入含酚酞的NaOH溶液中,红色消失
SO2有漂白性
A、A B、B C、C D、D13. 生产上用过量烧碱溶液处理某矿物 含 、 ,过滤后得到的滤液用 溶液,测得溶液pH、 随加入 溶液体积变化的曲线如图所示。下列有关说法错误的是( )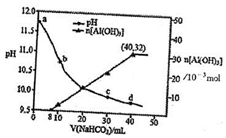 A、 溶液的物质的量浓度为 B、生成沉淀的离子方程式为 C、a点溶液中大量存在的离子是 、 、 D、b点与c点溶液所含微粒种类相同
A、 溶液的物质的量浓度为 B、生成沉淀的离子方程式为 C、a点溶液中大量存在的离子是 、 、 D、b点与c点溶液所含微粒种类相同二、多选题
-
14. 焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染等方面应用广泛。利用SO2生产Na2S2O5的工艺如图:
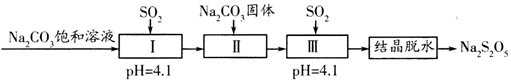
资料:Na2S2O5通常是由NaHSO3过饱和溶液经结晶脱水制得,下列说法正确的是( )
A、Na2S2O5是Na2SO3和SO2的混合物 B、pH=4.1时,I中主要反应的化学方程式为Na2CO3+SO2=Na2SO3+CO2 C、加入Na2CO3固体的目的是调节pH,促进Ⅲ中SO2的再吸收 D、“结晶脱水”过程中反应的化学方程式为2NaHSO3=Na2S2O5+H2O三、综合题
-
15. 三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子,某化学兴趣小组对Na2CS3的一些性质进行了探究性实验。(1)、实验Ⅰ.探究Na2CS3的性质:
步骤
操作及现象
①
取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份
②
向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色
③
向另一份溶液中滴加用硫酸酸化的KMnO4溶液,紫色褪去
H2CS3是(填“强”或“弱”)酸。
(2)、已知步骤③中反应的氧化产物是SO42- , 则该反应的离子方程式为:。(3)、某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量。你是否同意他的观点,并说明理由:。(4)、实验Ⅱ.测定Na2CS3溶液的浓度:按如图所示装置进行实验:将50.0mLNa2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0mol·L-1的稀H2SO4 , 关闭活塞。

已知:CS32- +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
仪器M的名称是。反应开始前需要先通入一段时间N2 , 其作用为。
(5)、B中发生反应的离子方程式为:。(6)、为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是。若B中生成沉淀的质量为8.4g,则Na2CS3溶液的物质的量浓度是。16. 新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4 Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2 某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
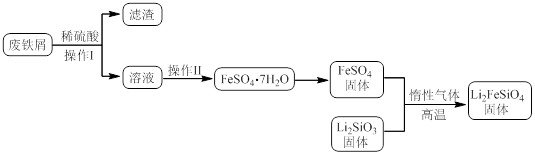
实验(二) Li2FeSiO4含量测定:
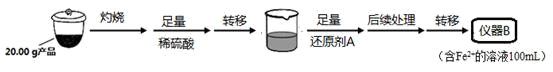
从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号
1
2
3
4
消耗KMnO4溶液体积
20.00 mL
19.98mL
21.38mL
20.02mL
(1)、实验(二)中的仪器名称:仪器B , 仪器C。(2)、制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是。(3)、操作Ⅱ的步骤 , 在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需。(4)、还原剂A可用SO2 , 写出该反应的离子方程式 , 此时后续处理的主要目的是。(5)、滴定终点时现象为;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量。(填“偏高”、“偏低”或“不变”)。17. 由于雾霾严重,长沙市19年12月15、16日在部分路段施行了限行。已知汽车尾气排放出的 NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。(1)、汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH
已知:CO燃烧热的ΔH1=-283.0kJ/mo1
N2(g)+O2(g)=2NO(g) ΔH2=+180.5kJ/mo1,则ΔH= 。
(2)、某研究小组对反应 NO2+SO2 SO3+NO ΔH <0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定 NO2 的平衡转化率 [α(NO2)],部分实验结果如图1所示。
①如果将图中B点的平衡状态改变为C点的平衡状态,应采取的措施是。
②图中B、D两点对应的实验温度分别为TB和TD , 通过计算判断:TBTD(填“>”“=”或“<”)。
(3)、工业废气也是产生雾霾的重要原因,某厂采用湿法 K2S2O8氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。①K2S2O8水解时生成 H2O2和 KHSO4 , 写出该反应的化学方程式:。
②过二硫酸钾可通过电解 KHSO4溶液的方法制得。电解液中含硫微粒主要存在形式与pH 的关系如图2所示。
已知在阳极放电的离子主要是 HSO ,阳极区电解质溶液的pH 范围为 ;阳极的电极反应式为。
18. 硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:(1)、写出与B元素同主族的 元素的基态原子核外电子排布式:。(2)、立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是。(3)、 分子中中心原子的杂化轨道类型是 , 微粒的空间构型是。(4)、 被认为是有机化学中的“万能还原剂”, 的电子式为 , 其中三种元素的电负性由大到小的顺序是。(5)、自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作 ,实际上它的结构单元是由两个 和两个 缩合而成的双六元环,应该写成 ,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是_______________(填字母)。
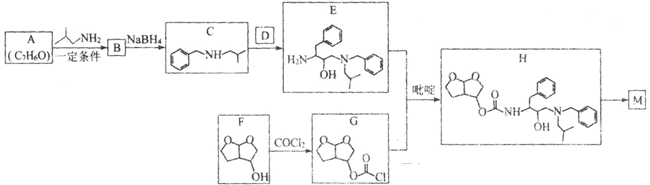
 A、离子键 B、共价键 C、氢键 D、金属键 E、范德华力(6)、磷化硼的晶胞如图所示,其化学式为 , 若晶胞中硼原子与磷原子之间的最近核间距为apm,则晶胞边长为cm。19. 化合物M(
A、离子键 B、共价键 C、氢键 D、金属键 E、范德华力(6)、磷化硼的晶胞如图所示,其化学式为 , 若晶胞中硼原子与磷原子之间的最近核间距为apm,则晶胞边长为cm。19. 化合物M( )是一种能有效抑制新型冠状病毒复制的药物中间体。实验室以芳香化合物A为原料制备M的一种合成路线如图所示:
)是一种能有效抑制新型冠状病毒复制的药物中间体。实验室以芳香化合物A为原料制备M的一种合成路线如图所示:
已知:① R1
 N
N  R2(R1、R2表示氢原子或烃基)
R2(R1、R2表示氢原子或烃基)②
 NR1R2
NR1R2请回答:
(1)、A的化学名称为;B的结构简式为;D中含氧官能团的名称为。(2)、F→G的化学方程式为。(3)、由E和G生成H的反应类型为;吡啶是一种有机碱,该反应中加入吡啶的作用为。(4)、碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子。M中含有手性碳原子的数目为。(5)、C的同分异构体中,属于芳香族化合物且核磁共振氢谱中有4组峰的结构简式为(任写2种即可)。(6)、写出用乙醇和乙胺(CH3CH2NH2)为原料制备化合物 NH
NH  的合成路线(其他无机试剂任选)。
的合成路线(其他无机试剂任选)。
-