河北省名校联盟2020-2021学年高三下学期化学开学考试试卷(新高考)
试卷更新日期:2021-03-30 类型:开学考试
一、单选题
-
1. 下列叙述不涉及氧化还原反应的是( )A、植物油加工成人造奶油 B、自然界中豆科植物进行氮的固定 C、雷雨天气空气中臭氧浓度增大 D、使用铝热剂焊接钢轨2. 下列有关说法错误的是( )A、 与 互为同位素 B、乙二醇和甘油不互为同系物 C、蛋白质溶液和NaCl溶液可根据丁达尔效应进行区分 D、卤水点豆腐、微波手术刀开刀处血液迅速凝固都是胶体的聚沉现象3. 在2019年9月25日,北京大兴国际机场正式投运。下列说法错误的是( )A、机场航站楼使用的玻璃为无机非金属材料 B、机场航站楼使用的隔震支座由橡胶和钢板相互粘结而成,属于新型无机材料 C、机场航站楼采用的钢铁属于合金材料 D、机场高速采用了新型自融冰雪路面技术,减少了常规融雪剂使用对环境和桥梁结构所造成的破坏4. 下列有关化学用语表示正确的是( )A、具有16个质子、18个中子和18个电子的微粒: B、硝基苯的结构简式:
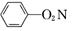 C、过氧化氢的电子式:
C、过氧化氢的电子式:  D、乙酸乙酯的分子式:
5. 奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维,该聚酯纤维的结构简式为
D、乙酸乙酯的分子式:
5. 奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维,该聚酯纤维的结构简式为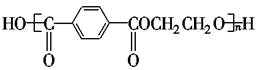 ,下列说法正确的是( ) A、羊毛与该聚酯纤维的化学成分相同 B、该聚酯纤维和羊毛在一定条件下均不能水解 C、由单体合成该聚酯纤维的反应属于加聚反应 D、合成该聚酯纤维的单体为对苯二甲酸和乙二醇6. 表示阿伏加德罗常数,下列说法正确的是( )A、 固体中离子总数为 B、 (羟基)所含电子数为 C、 与足量浓盐酸反应转移电子数为 D、常温下, 溶液中 数目小于7. 用 和 的混合溶液可溶出废旧印刷电路板上的铜。已知:
,下列说法正确的是( ) A、羊毛与该聚酯纤维的化学成分相同 B、该聚酯纤维和羊毛在一定条件下均不能水解 C、由单体合成该聚酯纤维的反应属于加聚反应 D、合成该聚酯纤维的单体为对苯二甲酸和乙二醇6. 表示阿伏加德罗常数,下列说法正确的是( )A、 固体中离子总数为 B、 (羟基)所含电子数为 C、 与足量浓盐酸反应转移电子数为 D、常温下, 溶液中 数目小于7. 用 和 的混合溶液可溶出废旧印刷电路板上的铜。已知:①
②
③
在 溶液中,1 mol 与 反应生成 和 的反应热 等于( )
A、 B、 C、 D、8. 氮循环是海洋生态系统的基础。海洋中无机氮循环的过程如图所示。下列叙述错误的是( )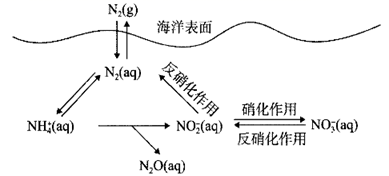 A、“硝化作用”可能有氧气的参与 B、氮循环中涉及氮的固定 C、向海水中大量排放含有 的废水会打破氮循环的稳态 D、 是歧化反应9. 科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法正确的是( )
A、“硝化作用”可能有氧气的参与 B、氮循环中涉及氮的固定 C、向海水中大量排放含有 的废水会打破氮循环的稳态 D、 是歧化反应9. 科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法正确的是( ) A、过程Ⅰ若通过原电池来实现,阴极电极反应式为 B、过程Ⅱ生成W的反应: C、过程Ⅲ中LiOH在阳极得电子生成金属锂,该体系中可用金属锂作阳极材料 D、过程Ⅲ中阴极电极反应式为10. a、b、c、d、e、f六种短周期元素,其原子半径与最高正价或最低负价之间的关系如图所示。下列说法错误的是( )
A、过程Ⅰ若通过原电池来实现,阴极电极反应式为 B、过程Ⅱ生成W的反应: C、过程Ⅲ中LiOH在阳极得电子生成金属锂,该体系中可用金属锂作阳极材料 D、过程Ⅲ中阴极电极反应式为10. a、b、c、d、e、f六种短周期元素,其原子半径与最高正价或最低负价之间的关系如图所示。下列说法错误的是( )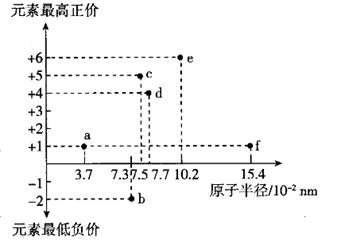 A、a、b、c三种元素形成的化合物中可能含有离子键,一定含有共价键 B、b、e、f三种元素的离子半径:f<b<e C、b、e、d三种元素简单气态氢化物的稳定性依次减弱 D、c、d、f的氢化物溶于水均显碱性11. 下列说法错误的是( )A、金属汞一旦滑落在实验室地面或桌面时,必须尽可能收集,并深埋处理 B、氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 C、做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 D、用pH计、电导率仅(一种测量溶渡导电能力的仪器)均可检测乙酸乙酯的水解程度12. 已知: 沸点约118℃,具有强还原性,能与NaClO剧烈反应生成 。实验室可采用NaClO氧化法制备 ,该反应的化学方程式为 (未配平)。以NA为阿伏加德罗常数的值,下列说法正确的是( )A、消耗40 g NaOH时,转移电子数目为NA B、常温下,pH=9的 溶液,水电离出 的数目为 NA C、已知 和NH3的水溶液均呈碱性,因此它们均属于弱电解质 D、若将少量的 滴加到 NaClO溶液中,将逸出氮气,整个过程转移6NA个电子13. 工业上利用 对烟道气进行脱硝(除氮氧化物)的SCR技术具有效率高、性能可靠的优势。SCR技术的原理为 和NO在催化剂( )表面转化为 和 ,反应进程中的相对能量变化如图所示。下列说法错误的是( )
A、a、b、c三种元素形成的化合物中可能含有离子键,一定含有共价键 B、b、e、f三种元素的离子半径:f<b<e C、b、e、d三种元素简单气态氢化物的稳定性依次减弱 D、c、d、f的氢化物溶于水均显碱性11. 下列说法错误的是( )A、金属汞一旦滑落在实验室地面或桌面时,必须尽可能收集,并深埋处理 B、氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 C、做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 D、用pH计、电导率仅(一种测量溶渡导电能力的仪器)均可检测乙酸乙酯的水解程度12. 已知: 沸点约118℃,具有强还原性,能与NaClO剧烈反应生成 。实验室可采用NaClO氧化法制备 ,该反应的化学方程式为 (未配平)。以NA为阿伏加德罗常数的值,下列说法正确的是( )A、消耗40 g NaOH时,转移电子数目为NA B、常温下,pH=9的 溶液,水电离出 的数目为 NA C、已知 和NH3的水溶液均呈碱性,因此它们均属于弱电解质 D、若将少量的 滴加到 NaClO溶液中,将逸出氮气,整个过程转移6NA个电子13. 工业上利用 对烟道气进行脱硝(除氮氧化物)的SCR技术具有效率高、性能可靠的优势。SCR技术的原理为 和NO在催化剂( )表面转化为 和 ,反应进程中的相对能量变化如图所示。下列说法错误的是( )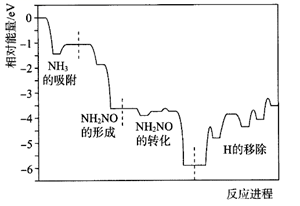 A、总反应方程式为 B、 是脱硝反应的活性中间体 C、升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度 D、决定反应速率的步骤是“H的移除”
A、总反应方程式为 B、 是脱硝反应的活性中间体 C、升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度 D、决定反应速率的步骤是“H的移除”二、多选题
-
14. 瑞德西韦是一种正在研发的广谱抗病毒药物,被初步证明在细胞水平上能有效抑制新型冠状病毒,其结构简式如下:
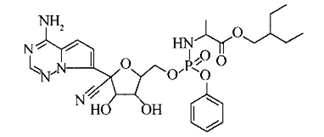
有关该化合物,下列叙述错误的是( )
A、能使酸性高锰酸钾溶液褪色 B、能发生水解反应 C、不能发生消去反应生成碳碳双键 D、1个分子中含有26个碳原子15. 25℃时,用0.1 NaOH溶液滴定20 mL 0.1 某二元弱酸 溶液,滴定过程中溶液的pH变化曲线如图所示。下列说法正确的是( )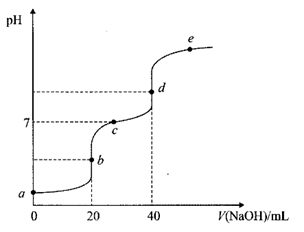 A、若a=2,则 B、b点溶液中: C、溶液中水的电离程度: D、d点溶液中:
A、若a=2,则 B、b点溶液中: C、溶液中水的电离程度: D、d点溶液中:三、综合题
-
16. 在工业上经常用水蒸气蒸馏的方法从橙子等水果果皮中收集橙油(主要成分是柠檬烯
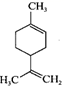 )。实验步骤如下:
)。实验步骤如下: Ⅰ提取柠檬烯
①将2~3个新鲜橙子皮剪成极小碎片后,投入100 mL烧瓶D中,加入约30 mL水,按照下图安装水蒸气蒸馏装置。
 Z
Z②松开弹簧夹G。加热水蒸气发生器A至水沸腾,当T形管的支管口有大量水蒸气冲出时夹紧弹簧夹G,开启冷却水,水蒸气蒸馏即开始进行。一段时间后可观察到在锥形瓶的馏出液的水面上有一层很薄的油层。
Ⅱ提纯柠檬烯
①将馏出液用10 mL二氯甲烷萃取,萃取3次后合并萃取液,置于装有适量无水硫酸钠的50 mL锥形瓶中。
②将锥形瓶中的溶液倒入50 mL蒸馏瓶中蒸馏。当二氯甲烷基本蒸完后改用水泵减压蒸馏以除去残留的二氯甲烷。最后瓶中只留下少量橙黄色液体,即橙油。
回答下列问题:
(1)、直玻璃管C的作用是。冷凝水从直形冷凝管的(填“a”或“b”)口进入。(2)、水蒸气蒸馏时,判断蒸馏结束的方法是;为了防止倒吸,实验停止时应进行的操作是。(3)、将馏出液用二氯甲烷萃取时用到的主要实验仪器是。(4)、无水硫酸钠的作用是。(5)、二氯甲烷的沸点为39.8℃,提纯柠檬烯时采用加热蒸馏的方法。17. 天然气的主要成分是甲烷,它是一种重要的化工原料。(1)、CH4与CO2经催化反应可制得合成气:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH已知:反应1:CH4(g)=C(s)+2H2(g) ΔH1=+75kJ/mol
反应2: 2CO(g)=C(s)+CO2(g) ΔH2=-172kJ/mol 则该催化反应的ΔH=kJ/mol。
(2)、工业上可用CO和H2合成二甲醚,其反应为: 2CO(g)+4H2 (g)=CH3OCH3 (g)+H2O(g) ΔH=-204.7 kJ/mol 初始条件相同时,分别在A(恒温)、B(绝热)两个容器内反应。反应初始时两容器的反应速率AB(填“>”、“<”或“=”,下同);平衡时CO的转化率AB。(3)、工业上可用CO和H2合成甲醇,其反应为CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·md。温度T时,在容积为2L的某密闭容器中进行上述反应,反应过程中相关数据如图所示。
①下列能表明该反应已达到平衡状态的是。
a v(H2)=2v(CH3OH) b c( CO)/c( CH3OH)=7: 3时
c c(H2)/c( CH3OH)=2: 1时 d 容器中气体的压强不再变化
②该化学反应10min内生成CH3OH的反应速率v(CH3OH)= 。
③该温度下,反应的平衡常数为 (列出计算式即可) 。
④若其他条件不变时,15mim时再向容器中加入2 mol CO和 x mol H2 , 平衡时CO的转化率与原平衡相同,则x=。
18. 联氨(N2H4)可以用于处理高压锅炉水中的氧,防止锅炉被腐蚀,其中一种可能的反应机理如图所示。回答下列问题: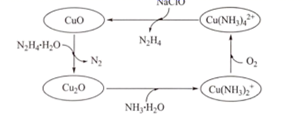 (1)、Cu2+基态核外电子排布式为。(2)、1molN2H4•H2O含σ键的数目为。(3)、Cu2O与NH3•H2O反应能形成较稳定的Cu(NH3)2+的原因是。(4)、N2H4的晶体类型是。N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃),沸点(114℃)分别远远高于O2的熔点(218℃),沸点(183℃),原因是。(5)、NaClO发生水解可生成HClO,HClO的空间构型是__,中心原子的杂化类型是__。(6)、已知Cu2O晶胞的结构如图所示:
(1)、Cu2+基态核外电子排布式为。(2)、1molN2H4•H2O含σ键的数目为。(3)、Cu2O与NH3•H2O反应能形成较稳定的Cu(NH3)2+的原因是。(4)、N2H4的晶体类型是。N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃),沸点(114℃)分别远远高于O2的熔点(218℃),沸点(183℃),原因是。(5)、NaClO发生水解可生成HClO,HClO的空间构型是__,中心原子的杂化类型是__。(6)、已知Cu2O晶胞的结构如图所示:
①在该晶胞中,Cu+的配位数是。
②已知该晶体密度为dg/cm3 , NA表示阿伏加德罗常数的数值,则晶胞参数α为nm(用含d和NA的代数式表示)。
19. 三草酸合铁(Ⅲ)酸钾品体 能溶于水,难溶于乙醇,该物质对光敏感,光照下即发生分解,产物之一是黄色的草酸亚铁。实验室可用如下流程来制备三草酸合铁(Ⅲ)酸钾晶体。根据题意完成下列各题: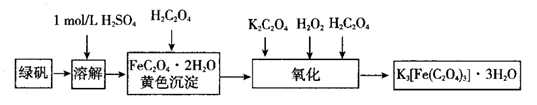 (1)、若用废铁屑和稀硫酸制备绿矾,需先将废铁屑碱煮水洗,其目的是;然后与硫酸反应时(填物质名称)往往要过量。(2)、要从溶液中得到绿矾晶体,必须进行的实验操作是(按前后顺序填字母)。
(1)、若用废铁屑和稀硫酸制备绿矾,需先将废铁屑碱煮水洗,其目的是;然后与硫酸反应时(填物质名称)往往要过量。(2)、要从溶液中得到绿矾晶体,必须进行的实验操作是(按前后顺序填字母)。a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
(3)、称取制得的绿矾晶体 ,加稀硫酸溶解。加入定量的草酸后,加热煮沸,形成黄色沉淀,过滤,洗涤。简述如何确定沉淀已经洗涤干净:。(4)、氧化过程中除不断搅拌外,还需维持温度在40℃左右,原因是;写出氧化生成三草酸合铁(Ⅲ)酸钾的离子方程式:。(5)、经过一系列操作后得到的最终产物晶体先用少量冰水洗涤,再用无水乙醇洗涤,低温干燥后称量,得到 翠绿色晶体,用无水乙醇洗涤晶体的目的是。(6)、列式计算本实验中三草酸合铁(Ⅲ)酸钾晶体的产率:(保留一位小数)。(7)、某同学制得的三草酸合铁(Ⅲ)酸钾晶体表面发黄,推测可能有部分晶体见光分解。为了验证此推测是否正确,可用的试剂是。20. 丁酸龙葵酯具有成熟李子、苹果和黑加仑的香气,是一种新型香料。一种合成路线如下: 已知: 。请回答下列问题:(1)、F的化学名称为 , C中含有的官能团的名称为。(2)、由苯生成A的反应类型为。(3)、由D生成E的反应试剂和条件为。(4)、B的结构简式可能为。(5)、由G生成H的化学方程式为。E和I反应生成丁酸龙葵酯的化学方程式为。(6)、在E的同分异构体中,遇氯化铁溶液发生显色反应的共有种(不含立体异构),其中,在核磁共振氢谱上有4组峰且峰的面积之比为1:2:3:6的结构简式为。
已知: 。请回答下列问题:(1)、F的化学名称为 , C中含有的官能团的名称为。(2)、由苯生成A的反应类型为。(3)、由D生成E的反应试剂和条件为。(4)、B的结构简式可能为。(5)、由G生成H的化学方程式为。E和I反应生成丁酸龙葵酯的化学方程式为。(6)、在E的同分异构体中,遇氯化铁溶液发生显色反应的共有种(不含立体异构),其中,在核磁共振氢谱上有4组峰且峰的面积之比为1:2:3:6的结构简式为。