广东省省名校联盟2020-2021学年高三下学期化学开学考试试卷(新高考)
试卷更新日期:2021-03-30 类型:开学考试
一、单选题
-
1. 化学与生活密切相关。下列物质性质与应用的对应关系错误的是( )A、硅胶吸水能力强,可用作食品、药品的干燥剂 B、氢氧化铝碱性不强,可用作胃酸中和剂 C、次氯酸钠具有强氧化性,可用作织物的漂白剂 D、葡萄糖具有氧化性,可用于工业制镜2. 漂白粉在水中可与溶解的CO2发生反应:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO。下列表示相关微粒的化学用语错误的是( )A、中子数为10的氧原子为 O B、Ca2+的结构示意图为
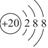 C、CO2的电子式为
C、CO2的电子式为 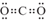 D、HClO的结构式为H-Cl-O
3. 下列成语或谚语中蕴含着一定的化学知识或原理,下列有关说法错误的是( )A、炉火纯青——通过观察火焰的颜色来判断炉内的温度 B、水滴石穿—— (以大理石为例) C、恨铁不成钢——钢的性能远优于铁 D、真金不怕火炼——单质金的熔点很高4. 我国在探索太空、开发深海、建设高铁、5G 技术联通等方面取得举世瞩目的成就,这些成就与化学有着密切联系。下列说法正确的是( )A、长征五号运载火箭箭体采用铝合金是为了美观耐用 B、大力发展太阳能、风能、氢能等新能源有利于生态文明建设 C、网络强国战略铺设光缆线路超三千万公里,光缆的主要成分是晶体硅 D、5G 手机电池工作时,电池中化学能完全转化为电能5. Li4Ti5O12、Na2Ti2O7、K2Ti3O7均是原电池中的正极材料,其制备方法为:在三乙烯四胺(分子式为C6H18N4 , 作为助溶剂)中水热法合成TiO2 , 然后控温160℃分别在LiOH溶液、NaOH溶液、KOH溶液中反应6小时。该过程中涉及的元素属于短周期元素的有( )A、6种 B、7种 C、8种 D、9种6. 下列装置能达到实验目的的是( )A、
D、HClO的结构式为H-Cl-O
3. 下列成语或谚语中蕴含着一定的化学知识或原理,下列有关说法错误的是( )A、炉火纯青——通过观察火焰的颜色来判断炉内的温度 B、水滴石穿—— (以大理石为例) C、恨铁不成钢——钢的性能远优于铁 D、真金不怕火炼——单质金的熔点很高4. 我国在探索太空、开发深海、建设高铁、5G 技术联通等方面取得举世瞩目的成就,这些成就与化学有着密切联系。下列说法正确的是( )A、长征五号运载火箭箭体采用铝合金是为了美观耐用 B、大力发展太阳能、风能、氢能等新能源有利于生态文明建设 C、网络强国战略铺设光缆线路超三千万公里,光缆的主要成分是晶体硅 D、5G 手机电池工作时,电池中化学能完全转化为电能5. Li4Ti5O12、Na2Ti2O7、K2Ti3O7均是原电池中的正极材料,其制备方法为:在三乙烯四胺(分子式为C6H18N4 , 作为助溶剂)中水热法合成TiO2 , 然后控温160℃分别在LiOH溶液、NaOH溶液、KOH溶液中反应6小时。该过程中涉及的元素属于短周期元素的有( )A、6种 B、7种 C、8种 D、9种6. 下列装置能达到实验目的的是( )A、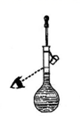 配制0.1mol·L-1NaCl溶液
B、
配制0.1mol·L-1NaCl溶液
B、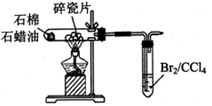 检验石蜡油分解产生了不饱和烃
C、
检验石蜡油分解产生了不饱和烃
C、 用渗析法分离葡萄糖与氯化钠的混合液
D、
用渗析法分离葡萄糖与氯化钠的混合液
D、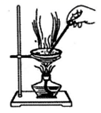 用陶瓷蒸发皿加热NaOH溶液获得纯净的NaOH固体
7. 汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
用陶瓷蒸发皿加热NaOH溶液获得纯净的NaOH固体
7. 汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )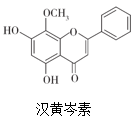 A、能与Na2CO3溶液反应放出气体 B、该物质遇FeCl3溶液不显色 C、1mol该物质与溴水反应,最多消耗2molBr2 D、与足量H2发生加成反应后,该分子中官能团的种类减少1种8. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )A、5.6L甲烷含有的共价键数为NA B、2gD2l6O和2gH218O中含有的中子数均为NA C、过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA D、常温下pH=13的Ba(OH)2溶液中含有的OH-离子数为0.1NA9. 下列操作不能达到实验目的的是( )
A、能与Na2CO3溶液反应放出气体 B、该物质遇FeCl3溶液不显色 C、1mol该物质与溴水反应,最多消耗2molBr2 D、与足量H2发生加成反应后,该分子中官能团的种类减少1种8. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )A、5.6L甲烷含有的共价键数为NA B、2gD2l6O和2gH218O中含有的中子数均为NA C、过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA D、常温下pH=13的Ba(OH)2溶液中含有的OH-离子数为0.1NA9. 下列操作不能达到实验目的的是( )选项
目的
操作
A
检验淀粉是否水解
先中和过量的酸,再加入新制氢氧化铜悬浊液,加热
B
制备氢氧化铁胶体
向10 mL沸水中加入10 mL饱和氯化铁溶液,继续煮沸一段时间
C
鉴别碳酸钠和碳酸氢钠溶液
逐滴向两种溶液中滴加稀盐酸
D
证明金属性:Zn>Fe
将锌片和铁片平行插入稀硫酸中,再用导线将二者相连
A、A B、B C、C D、D10. 含钯(Pd)催化剂可用于石油化工行业催化加氢和催化氧化。从失活的含钯催化剂(含Pd、Al2O3和有机物)中提取Pd的一种流程如下: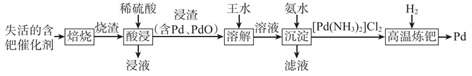
下列说法错误的是( )
A、“焙烧”的主要目的是除去有机物 B、金属Pd的还原性弱于金属Al C、上述流程中含钯物种均难溶于水 D、“高温炼钯”过程中可能产生白烟11. 我国科学家成功合成了世界上首个含五氮阴离子的盐,局部结构如图,其中含有两种10电子离子、一种18电子离子。X、Y、Z、M为原子序数依次增大的短周期元素,且均不在同一族。下列说法错误的是( )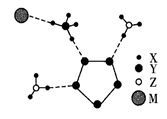 A、常温下,X、Y、Z、M的单质均为气体 B、在该盐中,存在极性共价键和非极性共价键 C、X、Y形成的最常见化合物的水溶液显碱性 D、M的氧化物对应的水化物均为强酸12. 化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。一定温度下,下列有关该反应的推理正确的是( )A、该反应达到平衡时:c(Cu2+)=c(Mn2+) B、平衡体系中加入少量CuS(s)后,c(Mn2+)变小 C、平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大 D、该反应平衡常数表达式:K=Ksp(CuS)/Ksp(MnS)13. 研究人员提出了一种基于Li元素的电化学过程来合成氨,其工艺路线如图所示,下列说法错误的是( )
A、常温下,X、Y、Z、M的单质均为气体 B、在该盐中,存在极性共价键和非极性共价键 C、X、Y形成的最常见化合物的水溶液显碱性 D、M的氧化物对应的水化物均为强酸12. 化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。一定温度下,下列有关该反应的推理正确的是( )A、该反应达到平衡时:c(Cu2+)=c(Mn2+) B、平衡体系中加入少量CuS(s)后,c(Mn2+)变小 C、平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大 D、该反应平衡常数表达式:K=Ksp(CuS)/Ksp(MnS)13. 研究人员提出了一种基于Li元素的电化学过程来合成氨,其工艺路线如图所示,下列说法错误的是( )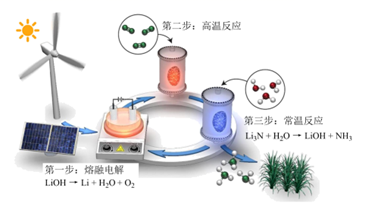 A、第一步每生成1mol氧气转移的电子数为4NA(NA为阿伏加德罗常数的值) B、第一步实现了能量转化:可再生能源→电能→化学能 C、第二步反应方程式为 6Li+N2 2Li3N D、该工艺的总反应为N2+3H2 2NH314. 我国科学家提出了由CO2和CH4转化为CH3COOH的催化反应历程。该历程示意图如下:
A、第一步每生成1mol氧气转移的电子数为4NA(NA为阿伏加德罗常数的值) B、第一步实现了能量转化:可再生能源→电能→化学能 C、第二步反应方程式为 6Li+N2 2Li3N D、该工艺的总反应为N2+3H2 2NH314. 我国科学家提出了由CO2和CH4转化为CH3COOH的催化反应历程。该历程示意图如下: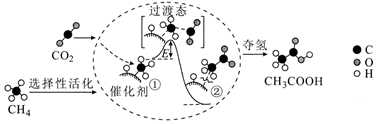
下列有关说法错误的是( )
A、原料到产品的总反应属于加成反应 B、CH3COOH分子中最多有7个原子共平面 C、①→②放出热量并形成了C一C键 D、CH4→CH3COOH过程中,有两种类型的化学键断裂15. 利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5 , 装置如图所示,下列说法正确的是( ) A、电极b反应式是O2+4e-+2H2O=4OH- B、乙装置d电极附近溶液的pH增大 C、c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+ D、每转移2mole-生成2molN2O5和1molH2SO416. 25℃时,向10.00 mL 0.1000 溶液中滴加相同物质的量浓度的氨水,测得混合溶液中 随滴加氨水体积的变化如图所示,下列说法错误的是( )
A、电极b反应式是O2+4e-+2H2O=4OH- B、乙装置d电极附近溶液的pH增大 C、c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+ D、每转移2mole-生成2molN2O5和1molH2SO416. 25℃时,向10.00 mL 0.1000 溶液中滴加相同物质的量浓度的氨水,测得混合溶液中 随滴加氨水体积的变化如图所示,下列说法错误的是( )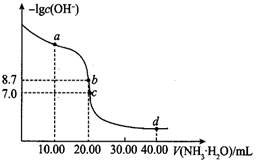 A、水的电离程度: B、 的数量级为 C、 点满足 D、 点满足
A、水的电离程度: B、 的数量级为 C、 点满足 D、 点满足二、综合题
-
17. 锌是一种常用金属,工业上利用锌焙砂(主要含ZnO、ZnFe2O4 , 还含有少量CaO、FeO、CuO、NiO 等)湿法制取金属锌的流程如图所示,回答下列问题。
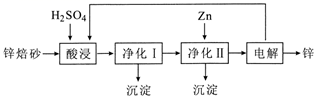
已知:Fe的活泼性强于Ni。
(1)、ZnFe2O4可写成ZnO•Fe2O3 , 则ZnFe2O4与H2SO4反应的化学方程式。(2)、“净化Ⅰ”操作分为两步:①将溶液中少量的 Fe2+氧化,下列试剂中可选用的是(填字母标号)。
A.新制氯水 B.30 % H2O2溶液 C.FeCl3溶液 D.KMnO4溶液
②加入ZnO,调节溶液pH为3.3~6.7;加热到60℃左右并不断搅拌,加热搅拌主要目的是。
(3)、“净化Ⅰ”生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是。(4)、“净化Ⅱ”中加入过量Zn的目的是。三、实验题
-
18. 化学小组探究FeCl3溶液与Na2S溶液的反应产物,利用图装置进行如下实验:
Ⅰ.向盛有0.1 mol•L-1FeCl3溶液的三颈瓶中,滴加一定量0.1 mol•L-1Na2S溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
Ⅱ.向盛有0.1 mol•L-1 Na2S溶液的三颈瓶中,滴加少量0.1mol•L-1 FeCl3溶液,搅拌,产生沉淀B。
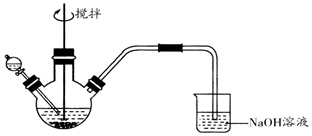
已知:①FeS2为黑色固体,且不溶于水和盐酸。②Ksp(Fe2S3)=1×10-88 , Ksp(FeS2)=6.3×10-31 , Ksp[Fe(OH)3]=1×10-38 , Ksp(FeS)=4×10-19
回答下列问题:
(1)、NaOH溶液的作用是。(2)、小组同学猜测,沉淀A、B可能为S、硫化物或它们的混合物。他们设计如下实验进行探究:实验一、探究A的成分
取沉淀A于小烧杯中,进行如下实验:

试剂X是。由此推断A的成分是(填化学式)。
(3)、实验二、探究B的成分取沉淀B于小烧杯中,进行如下实验:

向试管a中加入试剂Y,观察到明显现象,证明溶液中存在Fe2+ . 试剂Y是 , 明显现象是。由此推断B的成分是(填化学式)。
(4)、请分析Ⅱ中实验未得到Fe(OH)3的原因是。四、原理综合题
-
19. 乙酸制氢具有重要意义:
热裂解反应:CH3COOH(g)=2CO(g)+2H2(g) ∆H=+213.7kJ·mol-1
脱羧基反应:CH3COOH(g)=CH4(g)+CO2(g) ∆H=−33.5kJ·mol-1
(1)、2CO(g)+2H2(g)=CH4(g)+CO2(g) ∆H=kJ·mol-1。(2)、在密闭容器中,利用乙酸制氢,选择的压强为(填“高压”或“常压”)。其中温度与气体产率的关系如图:
①约650℃之前,脱羧基反应活化能低,反应速率快,很快达到平衡,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是。
②保持其他条件不变,在乙酸气中掺杂一定量的水,氢气产率显著提高而CO的产率下降,请用化学方程式表示。
(3)、保持温度为T℃,压强为pkPa不变的条件下,在密闭容器中投入一定量的醋酸发生上述两个反应,达到平衡时热裂解反应消耗乙酸20%,脱羧基反应消耗乙酸60%,则平衡时乙酸体积分数为(结果保留1位小数);脱羧基反应的平衡常数Kp为kPa(结果保留1位小数)。(4)、光催化反应技术使用CH4和(填化学式)直接合成乙酸,且符合“绿色化学”的要求(原子利用率100%)。(5)、若室温下将amol/L的CH3COOH溶液和bmol/LBa(OH)2溶液等体积混合,恢复室温后有2c(Ba2+)=c(CH3COO-),则乙酸的电离平衡常数Ka=(用含a和b的代数式表示)。20. 卡托普利(E)是一种血管紧张素转化酶抑制剂,被应用于治疗高血压和某些类型的充血性心力衰竭。合成路线如下: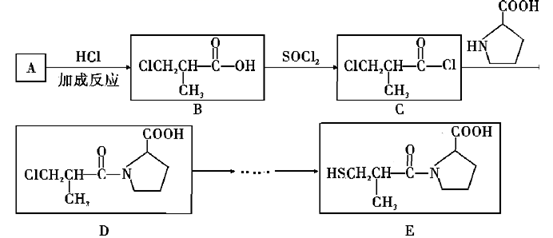 (1)、A中官能团的名称是 , A→B反应方程式为。C→D的反应类型是。(2)、1molD与NaOH溶液反应,最多消耗NaOH(3)、卡托普利E的分子中有个手性碳原子,下列关于E说法错误的是。
(1)、A中官能团的名称是 , A→B反应方程式为。C→D的反应类型是。(2)、1molD与NaOH溶液反应,最多消耗NaOH(3)、卡托普利E的分子中有个手性碳原子,下列关于E说法错误的是。a.卡托普利的水溶液呈酸性 b.在氧气中充分燃烧的产物中含有SO2
c.E的分子式为C9H16NO3S d.E存在属于芳香族化合物的同分异构体
(4)、A与浓硫酸、甲醇反应生成M,M的同分异构体在核磁共振氢谱图中出现两种信号峰、且只有一种官能团,该同分异构体可能结构为、。M加聚反应生成高分子化合物N的方程式为。21. 硫、钒化合物在药物化学及催化化学等领域应用广泛。回答下列问题:(1)、基态钒原子的价层电子排布图为 , 钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是 , 的空间构型为。(2)、2-巯基烟酸氧钒配合物(图甲)是副作用小的有效调节血糖的新型药物: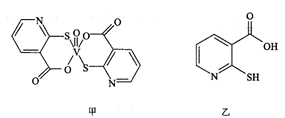
该药物中N原子的杂化方式是;2-巯基烟酸(图乙)水溶性优于2-巯基烟酸氧钒配合物(图甲)的原因是。
(3)、某六方硫钒化合物晶体的晶胞如图丙所示,该晶胞的化学式为。图丁为该晶胞的俯视图,该晶胞的密度为 (列出计算式即可)。
-
-